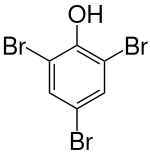
2,4,6-Tribromphenol
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | 2,4,6-Tribromphenol | |||||||||||||||||||||
| Andere Namen |
|
|||||||||||||||||||||
| Summenformel | C6H3Br3O | |||||||||||||||||||||
| Kurzbeschreibung |
weiß bis rötlich-weißer Feststoff |
|||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 330,79 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest |
|||||||||||||||||||||
| Dichte |
2,55 g·cm−3 (20 °C) |
|||||||||||||||||||||
| Schmelzpunkt |
89–92 °C |
|||||||||||||||||||||
| Siedepunkt |
244 °C |
|||||||||||||||||||||
| pKS-Wert |
6,08 |
|||||||||||||||||||||
| Löslichkeit |
sehr schlecht in Wasser (71 mg·l−1 bei 15 °C) |
|||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
2,4,6-Tribromphenol (TBP) ist eine chemische Verbindung, die sowohl zu den Phenolen als auch zu den Halogenaromaten zählt. Die Struktur besteht aus einem Benzolring mit angefügter Hydroxygruppe (–OH) und drei Bromatomen (–Br) als Substituenten. Es wird u. a. als Flammschutzmittel verwendet.
Inhaltsverzeichnis
Darstellung
2,4,6-Tribromphenol 2 entsteht durch direkte Bromierung von Phenol 1 mit elementarem Brom in Gegenwart von Kaliumbromid. Wird Brom dabei im Überschuss verwendet, reagiert das 2,4,6-Tribromphenol zu 2,4,4,6-Tetrabrom-2,5-cyclohexadienon (alter Trivialname: Tribromphenolbrom, Schmelzpunkt 124 °C) weiter. Diese Folgereaktion kann mit Iodwasserstoff umgekehrt werden.
Eigenschaften
2,4,6-Tribromphenol bildet weißlich-rosafarbene Schuppen, die bei 87–90 °C schmelzen. Der Siedepunkt liegt bei 282–290 °C. Aufgrund des −I-Effekts der Bromsubstituenten weist es eine höhere Acidität im Vergleich zum Phenol auf. Der pKs-Wert mit 6,08 ist daher deutlich niedriger (Phenol: 9,99).
Reaktionen
Bei der Nitrierung von 2,4,6-Tribromphenol wird das Bromatom an der para-Position von der Nitrogruppe verdrängt, es bildet sich 2,6-Dibrom-4-nitrophenol. Geht man jedoch vom Ethylether des 2,4,6-Tribromphenols aus, so wird die Nitrogruppe an der Position 3 angelagert, es bildet sich also 1-Ethoxy-2,4,6-tribrom-3-nitrobenzol. Organismen metabolisieren 2,4,6-Tribromphenol zu 2,4,6-Tribromanisol.
Beim Kochen mit Zinkstaub und Eisessig wird ein Bromatom aus der ortho-Position abgespalten, es entsteht 2,4-Dibromphenol.
Umweltrelevanz und Gefahren
Im Elektroschrott wurde in einer 2011 durchgeführten Studie eine durchschnittliche Konzentrationen von 18 ppm gefunden, was das Vorkommen von TBP in elektronischen Geräten bestätigte.
2,4,6-Tribromphenol wurde 2012 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von 2,4,6-Tribromphenol waren die Besorgnisse bezüglich der Einstufung als CMR-Stoff, hoher (aggregierter) Tonnage, hohes Risikoverhältnis (Risk Characterisation Ratio, RCR) und weit verbreiteter Verwendung sowie der Gefahren ausgehend von einer möglichen Zuordnung zur Gruppe der PBT/vPvB-Stoffe. Die Neubewertung fand ab 2012 statt und wurde von Norwegen durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht.
Weblinks
- Prof. Blumes Bildungsserver für Chemie: Zweitsubstitution von Phenol am Beispiel der Bromierung und Nitrierung.



