Antibiotikaassoziierte Kolitis
| Klassifikation nach ICD-10 | |
|---|---|
| A04.7 | Enterokolitis durch Clostridium difficile - Pseudomembranöse Kolitis |
| ICD-10 online (WHO-Version 2019) | |
Eine antibiotikaassoziierte Kolitis oder pseudomembranöse Kolitis entsteht, wenn die Darmflora (meist iatrogen bedingt) durch Antibiotika so sehr geschädigt wird, dass sich auf diese Weise insbesondere das Bakterium Clostridioides difficile sehr stark vermehren kann. Die von den Clostridien ausgeschiedenen Toxine verursachen Fieber, Bauchschmerzen, Durchfall und Flüssigkeitsverlust.
Inhaltsverzeichnis
Vorkommen
Clostridioides difficile ist ein grampositives, anaerobes Bakterium und kein Bestandteil der physiologischen Darmflora, allerdings bei Erwachsenen in 3–7 % und bei Säuglingen in über 50 % der Fälle dennoch nachweisbar, ohne dass diese erkrankt wären. Patienten im Krankenhaus scheiden Clostridioides difficile mit einer Wahrscheinlichkeit von 40 % aus.
Jedes Antibiotikum kann auch noch bis zu vier Wochen nach dessen Absetzen eine antibiotikaassoziierte Kolitis auslösen, auch diejenigen, die in der Regel zu ihrer Behandlung eingesetzt werden.
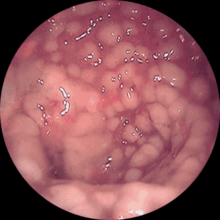
Durch die von den Clostridien ausgeschiedenen Giftstoffe (große clostridiale Zytotoxine: Toxin A und Toxin B) kann eine Diarrhoe mit teilweise sehr schwerem Verlauf entstehen, die lebensbedrohlichen Flüssigkeitsverlust durch (blutige) Durchfälle beinhalten kann. Das Gift des Clostridioides difficile zerstört dabei die Schleimhautschichten und es kommt zu „vulkanartigen“ Fibrinausschwitzungen, die in der Koloskopie als „Katzenköpfe“ beschrieben werden.
2002 wurde der NAP1-Stamm (North American Pulsed field type 1) in Nordamerika beschrieben, der deutlich mehr Toxine bilden kann und deshalb als virulenter gilt.
Symptome
Durchfall und Bauchkrämpfe sind die Leitsymptome der Erkrankung, können aber auch viele andere Ursachen haben. Nur rund 10–20 % aller Patienten mit Verdacht auf C. difficile sind auch im Labortest positiv. Dabei wurde sowohl von Patienten als auch von Ärzteseite der Stuhl in vielen Fällen als charakteristisch übelriechend beschrieben.
Risikofaktoren
Da Clostridioides difficile im sauren Milieu des Magens weitgehend zerstört wird, stellen Protonenpumpenhemmer einen Risikofaktor für eine Antibiotika-assoziierte Diarrhoe dar.
Darüber hinaus begünstigen verschiedene Antibiotika die Besiedlung mit Clostridien mehr als andere; besonders hervorzuheben sind Clindamycin, Penicilline (Amoxicillin, Ampicillin), Cephalosporine und Chinolon-Antibiotika. Antibiotika stören die physiologische Darmflora, die in gesundem Milieu als „Platzhalter“ fungiert. Außerdem sorgen sie für Verschiebungen im Gallensäurehaushalt, so dass die Vermehrung von vegetativen Formen des C. difficile nicht mehr ausreichend gehemmt wird.
Diagnose

Hinweisend auf eine durch C. difficile ausgelöste Kolitis sind Fieber und eine Leukozytose. Diese kann sehr hohe Werte (>30.000/µL) erreichen. Nach US-amerikanischen Leitlinien der SHEA wird die Erkrankung ab 15.000/µL oder bei einer Schädigung der Nieren (Kreatininanstieg um das 1,5fache) als schwer bezeichnet. Dabei korreliert die Leukozytenzahl mit dem Sterberisiko.
Im Ultraschall und in der Computertomographie kann man die langstreckige Darmwandverdickung des Dickdarmes erkennen. Endoskopisch sieht man im Dickdarm grünliche Fibrinbeläge, die teils fleckig, teils flächenhaft zu finden sind.
Die endgültige Diagnose erfolgt durch verschiedene Tests des Stuhls auf Vorhandensein des Erregers oder seiner Toxine. Als Goldstandard gilt der Zytotoxin-Assay. Dabei werden Fibroblasten mit Proben des Stuhls kontaminiert. In Anwesenheit von Clostridientoxinen sind charakteristische Veränderungen mikroskopisch sichtbar. Diese Veränderungen werden wiederum durch Antitoxin rückgängig gemacht, um die Diagnose zu bestätigen. Der Test ist jedoch technisch aufwändig und braucht zwei bis drei Tage. Ebenso ist eine toxinbildende Kultur möglich. Dabei werden andere Bakterien durch Hitze oder Alkohole zerstört und die Zellkultur auf das Vorhandensein der Toxine überprüft. Der Test benötigt rund 3–5 Tage. Beide Tests sind sehr sensitiv und relativ spezifisch.
Der gebräuchlichste Test ist jedoch ein Enzymimmunoassay gegen die Toxine selbst oder ein Enzym (Glutamatdehydrogenase) der Bakterien. Beide Tests sind weniger sensitiv als die vorhergehenden Methoden. Jedoch sind sie technisch einfach, kostengünstig und binnen Stunden durchführbar. Der Test auf das Bakterienenzym zeigt dabei nur das Vorhandensein der Bakterien an, nicht ihre Toxinproduktion. Infolgedessen ist es sinnvoll, beide Tests zu kombinieren. Ebenso schnell, jedoch teurer ist eine PCR, welche die DNA des Bakteriums nachweist.
Differentialdiagnose
Die pseudomembranöse Kolitis ist abzugrenzen von der einfachen, Antibiotika-assoziierten Diarrhoe, die nicht durch eine Darmentzündung ausgelöst wird.
Eine seltenere Form der Antibiotika-assoziierten Kolitis ist die durch Klebsiellen ausgelöste, Antibiotika-assoziierte hämorrhagische Kolitis. Sie betrifft häufig junge, sonst gesunde Patienten und geht mit Bauchkrämpfen und blutigen Durchfällen einher.
Therapie
Erste Maßnahme zur Therapie stellt, sofern möglich, das Absetzen des auslösenden Antibiotikums dar, daneben Unterstützung des Wasser- und Elektrolythaushalts. Als Standardmittel in der klinischen Praxis gilt Metronidazol. Generell wird Vancomycin als Reservemittel (bei Metronidazol-Unverträglichkeit oder -Allergie, Schwangerschaft, Kindern unter zehn Jahren oder Metronidazol-Resistenz) oder zusätzlich zu Metronidazol schwereren Verläufen (mit mehr als vier Stuhlentleerungen pro Tag, schlechtem Allgemeinbefinden, beginnendem Fieber und Entzündungszeichen) vorbehalten. Bei Therapieresistenz wird ein Versuch mit Bacitracin, Fusidinsäure oder Teicoplanin empfohlen, wobei es bei diesen Alternativen zu einer höheren Rezidivrate als mit Metronidazol und Vancomycin kommen soll. Ein systematisches Cochrane-Review hingegen kam zu dem Schluss, dass Vancomycin und Teicoplanin die höchste Wirksamkeit zur symptomatischen Heilung des Patienten besitzen. Teicoplanin ist jedoch sehr teuer und wenig verfügbar. Teicoplanin biete eine höhere Wahrscheinlichkeit, dass der Keim im Darm eines Patienten nicht mehr nachweisbar wird, und dadurch eine Möglichkeit, Nosokomiale Infektionen in Gesundheitseinrichtungen zu begrenzen.
Rund ein Fünftel der Patienten erleidet, in der Regel im Anschluss an die erfolgreiche medikamentöse Behandlung, einen Rückfall. Dieser wird in der Hälfte der Fälle durch Neubesiedlung mit Clostridioides difficile, zur anderen Hälfte durch inkomplette Eliminierung des Keims verursacht. Bei einem ersten Rückfall wird eine nochmalige Therapie mit Metronidazol oder Vancomycin in gleicher Dosierung und Dauer angestrebt. Im Fall eines zweiten Rückfalls hat sich eine längere Einnahme über 7 Wochen in ausschleichender Dosierung bewährt. Im Mai 2011 hat die Food and Drug Administration in den USA mit Fidaxomicin ein Makrozyklinantibiotikum zugelassen, das speziell für den Einsatz gegen Clostridioides difficile entwickelt wurde. Breite klinische Evaluation des Wirkstoffs stehen noch aus. Die Europäische Arzneimittel-Agentur erteilte im September 2011 die Zulassung für die Indikation der Clostridien-assoziierten Enteritis.
In vielen Versuchen hat sich die sogenannte fäkale Bakteriotherapie (umgangssprachlich „Stuhltransplantation“) als erfolgversprechend erwiesen. Der Ansatz geht davon aus, dass eine geschädigte Darmflora – was im Nachgang zu einer Antibiotika-Behandlung häufig vorkommt – Rückfälle stark begünstigt, da Clostridioides-difficile-Keime sich dank fehlender Konkurrenz ungehindert vermehren können. Bei dieser unkomplizierten Behandlung wird der Stuhl eines gesunden Spenders zusammen mit physiologischer Kochsalzlösung püriert und mittels eines Einlaufs in den Dickdarm des Patienten gegeben. Die Verabreichung des Stuhls kann auch durch eine Nasoduodenalsonde oder mit Kapseln erfolgen. Gemäß einer aktuellen Metastudie wurden 92 % der Patienten dauerhaft geheilt. 2014 wurden in einer ersten Pilotstudie mit oral eingenommenem, in Pillenform gekapseltem Wirkstoff ähnlich gute Resultate erzielt.
In seltenen Fällen kann eine chirurgische Therapie notwendig sein. Dabei wird die totale Entfernung des Dickdarms gegenüber einer Teilentfernung als überlegen angesehen.
Hygienemaßnahmen
Um einer Infektionsverbreitung vorzubeugen, müssen im Umgang mit Erkrankten bestimmte Hygienemaßnahmen konsequent eingehalten werden. Dazu gehört die Basishygiene, wobei dem Händewaschen besondere Bedeutung zukommt: Bei Kontakt mit bestimmten sporenbildenden Erregern wie Clostridioides difficile können nur durch Händewaschen möglicherweise anhaftende Sporen reduziert werden, da sie durch die üblichen Hautdesinfektionsmittel auf Alkoholbasis nicht inaktiviert werden.
Außerdem empfiehlt die Kommission für Krankenhaushygiene und Infektionsprävention (KRINKO) bei Verdacht auf oder bei diagnostizierter Clostridioides-difficile-Infektion (CDI) neben Barrieremaßnahmen, den symptomatischen Patienten in einem Einzelzimmer mit eigener Nasszelle unterzubringen und diese Isolierung bis mindestens 48 Stunden nach Ende der Durchfallsymptomatik aufrechtzuerhalten.
Komplikationen
Als Folge tritt wie bei jeder schweren Durchfallerkrankung ein Flüssigkeitsmangel (Dehydratation) auf. Als weitere Komplikationen können ein toxisches Megakolon, eine Perforation des Kolons, eine Durchwanderungsperitonitis und ein septischer Schock auftreten.
Diesen Krankheitsverlauf bezeichnet man als fulminante Kolitis. Rund vier Prozent der Patienten haben einen fulminanten Verlauf. Drei Faktoren konnten als unabhängige Vorhersagefaktoren für einen tödlichen Verlauf identifiziert werden: Alter über 70 Jahre, starke Vermehrung oder Verminderung der weißen Blutzellen sowie Versagen des Herz-Kreislauf-Systems mit der Notwendigkeit medikamentöser Kreislaufunterstützung oder Intubation. Ein 2002 erstmals bei einer Epidemie in Québec isolierter Stamm namens NAP1/027, der eine Toxinüberproduktion in-vitro zeigt, wurde mit schwerwiegenderen Krankheitsverläufen in Verbindung gebracht.
Forschungsgeschichte
Die erste Assoziation mit dem Antibiotikum Clindamycin und feingewebliche Beschreibung der Erkrankung erfolgte während der 1970er Jahre. Die Erkrankung wurde 1977 zuerst von einer Forschergruppe um John Bartlett auf Clostridium difficile zurückgeführt.
Ökonomische Bedeutung
Fälle von antibiotikaassoziierter Colitis bedingen zahlreiche, kostenintensive Maßnahmen in Krankenhäusern und Pflegeeinrichtungen. Insbesondere eine epidemieartige Ausbreitung unter hospitalisierten Patienten kann erhebliche Betriebsstörungen bis zur Schließung ganzer Abteilungen nach sich ziehen. In der Mitte des letzten Jahrzehnts durchgeführte Schätzungen gehen von rund 3 Milliarden Euro Kosten pro Jahr in der Europäischen Union und 1,1 Milliarden US-Dollar in den USA aus.
Siehe auch
Literatur
- Marianne Abele-Horn: Antimikrobielle Therapie. Entscheidungshilfen zur Behandlung und Prophylaxe von Infektionskrankheiten. Unter Mitarbeit von Werner Heinz, Hartwig Klinker, Johann Schurz und August Stich, 2., überarbeitete und erweiterte Auflage. Peter Wiehl, Marburg 2009, ISBN 978-3-927219-14-4, S. 191–193.
Weblinks
- Endoskopieatlas: Colon (mit endoskopischen Bildern)
- Endoskopischer Atlas (mit endoskopischen Bildern)
- Diagnose: Pseudomembranöse Enterokolitis (mit histologischen Bildern)