
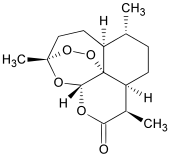
Artemisinin
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Artemisinin | |||||||||||||||||||||
| Andere Namen |
(3R,5aS,6R,8aS,9R,12S,12aR)-Octahydro-3,6,9-trimethyl-3,12-epoxy-12H-pyrano[4,3-j]-1,2-benzodioxepin-10(3H)-on |
|||||||||||||||||||||
| Summenformel | C15H22O5 | |||||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff |
|||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 282,34 g·mol−1 | |||||||||||||||||||||
| Schmelzpunkt |
|
|||||||||||||||||||||
| Löslichkeit |
|
|||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Artemisinin ist ein sekundärer Pflanzenstoff aus der chemischen Gruppe der Sesquiterpene, der in den Blättern und Blüten des Einjährigen Beifußes (Artemisia annua) vorkommt. Charakteristika der Artemisininstruktur sind ein Trioxanringsystem und eine Peroxidbrücke. Halbsynthetisch hergestellte Abkömmlinge des Artemisinins werden in Form von Kombinationstherapien weltweit zur Behandlung von Infektionen mit multiresistenten Stämmen von Plasmodium falciparum, dem Erreger der Malaria tropica, eingesetzt. Die Verwendung pflanzlicher Artemisia-Präparate (z. B. in Form von Tees) zur Vorbeugung oder Behandlung von Malaria ist gemäß einer Stellungnahme der WHO nicht empfehlenswert.
Inhaltsverzeichnis
Gewinnung
Der Einjährige Beifuß, aus dem Artemisinin gewonnen wird, wird in China, Vietnam und in ostafrikanischen Ländern angebaut. Die Gewinnung erfolgt durch die Extraktion getrockneter Blätter und Blüten mit n-Hexan, worin der Wirkstoff, der überwiegend in den ätherischen Öldrüsenschuppen lokalisiert ist, gut löslich ist. Alternative Lösungsmittel wurden ebenfalls evaluiert, um das n-Hexan zu ersetzen, haben aber bisher noch keine praktische Anwendung gefunden. Auf einer Anbaufläche von einem Hektar lassen sich bis zu zwei Tonnen Blattmaterial ernten, die zwei bis drei Kilogramm des Extraktes liefern. Der Artemisiningehalt in der Wildtyp-Pflanze liegt zwischen 0,1 und 0,4 % bezogen auf das Trockengewicht. Züchtungen mit einem Wirkstoffgehalt bis zu 1,4 % sind bekannt. Aus dem eingedampften Rohextrakt, einem gelben, viskosen Öl, wird Artemisinin durch Umkristallisation gewonnen. Dieses Verfahren ist relativ teuer und folglich der Preis für Artemisinin sehr hoch.
Großtechnische Herstellung
Peter Seeberger und François Lévesque stellten Anfang 2012 ein neues, sehr einfaches Verfahren zur Gewinnung von Artemisinin aus Artemisininsäure vor. Artemisininsäure lässt sich in größeren Mengen aus dem Einjährigen Beifuß gewinnen als Artemisinin. Es handelt sich hierbei somit um eine Semisynthese. In dem Verfahren kann durch Hydrierung der terminalen Doppelbindung und anschließende Umsetzung des daraus resultierenden Dihydroartemisinins im Rohrreaktor mit geringem Aufwand Artemisinin produziert werden. Dieses Verfahren ist insbesondere aus dem Grund der einfachen Skalierbarkeit der Produktion von Relevanz.
Im Jahr 2013 veröffentlichten Paddon und Mitarbeiter einen Prozess zur kostengünstigen Herstellung von Artemisininsäure mithilfe von genmanipulierter Bierhefe (Saccharomyces cerevisiae), der nicht durch Patente belastet ist.
Seit April 2013 ist im norditalienischen Garessio eine Anlage der Firma Sanofi in Betrieb, die pro Jahr bis zu 40 Tonnen Artemisinin herstellen soll. Die Anlage ist Resultat eines Projektes der Bill-und-Melinda-Gates-Stiftung, der Organisation One World Health (jetzt Path) und weiterer Partner, das seit 2004 lief. Artemisinin wird halbsynthetisch durch photochemische Oxidation aus fermentativ produzierter Artemisininsäure dargestellt. Die Anlage arbeitet in einem semi-kontinuierlichen Verfahren. Die Tonnage der Anlage soll auf 60 Tonnen pro Jahr erhöht werden. 10 bis 15 Prozent der produzierten Menge Artemisinin werden direkt verkauft, der Rest wird zum Wirkstoff Artesunat (AS) umgesetzt, der in fixer Kombination zusammen mit Amodiaquin (AQ), ebenfalls ein Antimalariawirkstoff, im Malariatherapeutikum ASAQ eingesetzt wird. Allerdings wurde in der Anlage, die auf gentechnisch veränderter Hefe basiert, im Jahr 2015 keinerlei Artemisinin hergestellt. Zudem wolle Sanofi die Anlage verkaufen, berichtete Nature im Februar 2016. Gründe seien der niedrige Preis für natürliches Artemisinin und die mangelnde Nachfrage von Herstellern von Malaria-Medikamenten.
Totalsynthese
Als Alternative zur Extraktion von Artemisinin aus dem Naturstoff wurden verschiedene Totalsynthesen aus einfacheren Molekülen untersucht. Eine Möglichkeit ergab sich in den 1980er Jahren bei der Umsetzung von (–)-Isopulegol zu Artemisinin. Die leichte Verfügbarkeit aus zum Beispiel Zitronengras und eine Übereinstimmung von drei stereogenen Zentren mit dem Zielmolekül waren die ausschlaggebenden Gründe für die Wahl des Eduktes.
Bei dem Syntheseweg müssten jedoch weiterhin vier Stereozentren sowie die Endoperoxidbrücke des Moleküls aufgebaut werden. Da nicht bei allen Schritten eine enantiomerenreine Umsetzung gewährleistet werden konnte, mussten einige Trenn- und Aufreinigungsschritte eingebaut werden. Dies ist mit hohem Aufwand verbunden und aus diesem Grund auch großtechnisch nicht rentabel. Zudem war die Ausbeute mit ungefähr 5 % auch zu niedrig, um dadurch eine Alternative zur Extraktion zu gewährleisten.
Eigenschaften
Die Verbindung kann in zwei polymorphen Formen auftreten. Das Polymorph I schmilzt bei 151,4 °C mit einer Schmelzenthalpie von 78,4 J·g−1, das Polymorph II bei 153,9 °C mit 70,5 J·g−1. Beide Formen stehen enantiotrop zueinander. Bei 130 °C kann mittels Röntgenpulverdiffraktometrie und DSC ein Festphasenübergang von Polymorph I zu Polymorph II beobachtet werden. Das Polymorph I kristallisiert in einem orthorhombischen Kristallgitter mit der Raumgruppe P212121 (Raumgruppen-Nr. 19)Vorlage:Raumgruppe/19, Polymorph II in einem triklinen Kristallgitter mit der Raumgruppe P1 (Raumgruppen-Nr. 1)Vorlage:Raumgruppe/1.
Analytik
Zur zuverlässigen qualitativen und quantitativen Bestimmung von Artemisinin wird die Kopplung der HPLC mit der Massenspektrometrie nach geeigneter Probenvorbereitung eingesetzt.
Einsatz als Medikament
Wirkungsweise
Der genaue Wirkungsmechanismus von Artemisinin und seiner Derivate bei einer Malariainfektion ist nicht bekannt. Artemisinin besitzt eine Peroxidstruktur, die für die Wirkung gegen Malaria ausschlaggebend ist. Bei hoher Konzentration an Eisenionen wird dieses Peroxid instabil und zerfällt in freie Radikale. Solche hohen Konzentrationen werden in Erythrozyten, aber auch in Plasmodien gefunden, die Eisen akkumulieren. Eine weit verbreitete Theorie besagt, dass die bei der homolytischen Spaltung der Peroxid-Gruppe entstehenden Radikale als Alkylierungsreagenzien fungieren. Diese beschädigen dann Proteine des Parasiten, was zum Absterben führt.
Derivate

Auf der Suche nach wirkungsvolleren Derivaten wurde erkannt, dass die Peroxidgruppe Artemisinins erhalten bleiben muss. Nach Reaktion mit Natriumborhydrid wurde zunächst Dihydroartemisinin erzeugt, was Grundlage verschiedener öl- und wasserlöslicher Derivate ist. Diese partialsynthetischen Derivate sind beispielsweise Artemether, Artesunat und Artemotil. Ihre Aktivität nimmt nach der Resorption allerdings schnell ab, was auf eine rasche Metabolisierung zurückgeführt wird. Um dieses Problem zu lösen, wird zusätzlich eine Komedikation gegeben:
- Artemether wird zusammen mit Lumefantrin eingesetzt, das die Metabolisierung hemmt und gleichzeitig einen antiplasmodialen Effekt aufweist. Die Halbwertszeit des Lumefantrins beträgt drei bis sechs Tage.
- Bei Artesunat gibt es folgende Kombinationstherapien: Artesunat/Mefloquin, Artesunat/Amodiaquin und Artesunat/Sulfadoxin/Pyrimethamin.
- Piperaquin kommt als Komedikation bei Dihydroartemisinin zur Verwendung.
Diese Kombinationstherapien werden mit ACT für Artemisinin-based combination therapy („Artemisinin-basierte Kombinationstherapie“) abgekürzt. Sie sind die erste Wahl zur Behandlung von Malaria.
Entwicklung von Resistenzen
In den Jahren 2008 und 2009 wurden Anzeichen für die Entwicklung von Resistenzen gegenüber Kombinationstherapien mit Artesunat in Pailin (Westkambodscha), unabhängige Resistenzentwicklungen gegenüber Plasmodium falciparum 2012 in Westthailand beschrieben.
Inzwischen breiten sich Resistenzen in Südostasien und China aus, bis 2016 wurden keine Resistenzen außerhalb dieses Bereichs gefunden. Die Mutationen konzentrieren sich um zwei geografische Foci, einer im Grenzgebiet zwischen Myanmar, Südchina und den westlichen Grenzregionen Thailands, der andere in Kambodscha, Laos und Vietnam. Dabei zeigen sich Mutationen im Plasmodium-Gen der β-Propeller-Domäne des Kelch-Proteins K13, das für ein hoch konserviertes Protein (PfKelch13) kodiert. Bisher wurden 13 Mutationen identifiziert, die mit einer verminderten Parasiten-Clearance verbunden sind. Aus der häufigsten Mutation, einem Einzelnukleotid-Polymorphismus (C580Y), resultiert in einer Fehlfaltung und damit in eine verminderte Bindung der Phosphoinositid-3-Kinasen. Andere, nicht auf C580Y-basierende Resistenzen bei PfKelch13 verbreiten sich auch in Südamerika, Neuguinea und Ostafrika aus, dort in Ruanda die Mutation R561H oder unabhängig davon im nördlichen Uganda die Mutationen A675V bzw. C469Y.
Durch die C580Y-Mutation in PfKelch13 verzögert sich die Entwicklung von P. falciparum, da sie Hämoglobin schlechter aufnehmen können. Sie bleiben dadurch länger in einem früheren Entwicklungsstadium, bei dem Artesunat seine Wirkung nicht entfalten kann. Dies verschafft dem Parasiten die nötige Zeit, hohe Spiegel des (kurzlebigen) Antimalariemittels zu überstehen.
In Afrika würde ein Auftreten einer Resistenz gegenüber Artemisinin jährlich ca. 80 Millionen zusätzliche Malariafälle mit etwa 10.000 Malariatoten verursachen.
Basierend auf einer Überprüfung der Studienlage zur Wirksamkeit sieht die WHO die Anwendung von Tee oder anderen Zubereitungen aus der Artemisia-Pflanze („Hausmittel“) sehr kritisch. Sie erklärte 2019 in einer Stellungnahme, die Verwendung von Artemisia-Pflanzenmaterial zur Prävention oder Behandlung von Malaria weder zu unterstützen noch zu fördern, unter anderem da:
- der Gehalt von Artemisinin in Pflanzen sehr stark variiert;
- er häufig zu niedrig ist, um alle Parasiten zu töten oder ein Wiederauftreten zu verhindern;
- eine weit verbreitete Anwendung mit diesen ungenügenden Wirkkonzentrationen rascher Resistenzen fördert und
- es wirksamere Therapien gegen Malaria gibt.
Geschichte
Die chinesische Wissenschaftlerin Tu Youyou isolierte Artemisinin in den frühen 1970er Jahren und zeigte in den folgenden Jahrzehnten seine Wirksamkeit gegen Malaria auf. Ausgangspunkt war die zunehmende Resistenzbildung der damals eingesetzten Therapeutika wie z. B. 1934 eingeführte und ab den 1950er Jahren stark eingesetzte Chloroquin. Dies wirkte sich auch auf den Vietnamkrieg aus: Die damalige nordvietnamesische Regierung forderte Hilfe aus China an, da Malaria die Leistungsfähigkeit ihres Militärs beeinflusste.
1967 startete China daraufhin mit der geheimen Initiative „Projekt 523“, die zum Ziel hatte, neue Medikamente gegen Malaria zu entdecken. Hierbei wurden antike medizinische Texte und Rezepte aus diversen Pflanzen untersucht. Tatsächlich wurde der Einjährige Beifuß mehrfach erwähnt. Zwar zeigten erste Extrakte eine Wirkung gegen Malaria, die Wirkstärke war jedoch sehr unterschiedlich und nicht reproduzierbar. Bei einem Rezept des chinesischen Alchemisten Ge Hong (341 v. Chr.) wurden mit kaltem Wasser hergestellte Säfte beschrieben – im Gegensatz zu einer klassischen Zubereitung mit heißem Wasser (z. B. als Tee). Youyou erkannte dies und merkte an, dass solche Kaltwasserauszüge aus Blättern die höchste Wirkung entfalten. Daraufhin wurden Extrakte bei niedriger Temperatur mittels Ether gewonnen, die jedoch toxisch waren. Durch Extraktion konnten saure Bestandteile der Mischung, die auch nicht gegen Malaria wirkten, entfernt werden. Die verbleibende neutrale Lösung zeigte bei Tierversuchen 1971 an Mäusen eine höchst effektive Wirkung gegen Malariaparasiten („Extrakt Nr. 191“). Auf der Basis dieser Ergebnisse versuchte das Forscherteam um Youyou Kristalle zu erhalten, jedoch gelang es ihrem Team nicht, pure Exemplare zu generieren. Jedoch schafften es Zeyuan Luo vom Yunnan Institute of Drug Research und Zhangxing Wei vom Shandong Institute of Chinese Traditional Medicine mithilfe der bereitgestellten Informationen die gewünschten Kristalle aus der Pflanze zu erhalten.
Durch intensive Forschung wurde 1972 schließlich Artemisinin („qinghaosu“) als Antimalaria-spezifische Komponente identifiziert und isoliert. Die Stereochemie des Sesquiterpens wurde 1975 am Institut für Biophysik der Chinesischen Akademie der Wissenschaften mit Sitz in Peking bestimmt und erstmals 1977 veröffentlicht.
Youyou wurde 2011 mit dem Albert Lasker Award for Clinical Medical Research und 2015 mit dem Nobelpreis für Physiologie oder Medizin ausgezeichnet.
Literatur
- Sanjeev Krishna et al.: Artemisinins: their growing importance in medicine. In: Trends in Pharmacological Sciences. Band 29, 2008, S. 520–527, doi:10.1016/j.tips.2008.07.004, PMC 2758403 (freier Volltext).
- Bernd Schäfer: Artemisinin. Teil 1 und Teil 2, In: Chemie in unserer Zeit. Band 48, Heft 2, April 2014, S. 134–145, doi:10.1002/ciuz.201400645 und Band 48, Heft 3, Juni 2014, S. 216–225, doi:10.1002/ciuz.201400652.
Weblinks
- Design und Synthese von Antimalaria Endoperoxiden
- Rolf Bökemeier: Ein Kraut wirkt Wunder. In: Geo. 2006; abgerufen am 20. Oktober 2021.
- Malaria parasites 'resist drugs'. In: BBC News. 29. Mai 2009; abgerufen am 20. Oktober 2021 (englisch).



