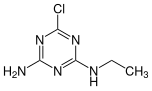
Atrazin
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Atrazin | |||||||||||||||||||||
| Andere Namen |
|
|||||||||||||||||||||
| Summenformel | C8H14ClN5 | |||||||||||||||||||||
| Kurzbeschreibung |
weißer bis beigefarbener, geruchloser Feststoff |
|||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 215,69 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest |
|||||||||||||||||||||
| Dichte |
1,23 g·cm−3 (22 °C) |
|||||||||||||||||||||
| Schmelzpunkt |
176 °C |
|||||||||||||||||||||
| Siedepunkt |
205 °C |
|||||||||||||||||||||
| Dampfdruck |
2,6·10−7 mbar (20 °C) |
|||||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser (33 mg·l−1 bei 22 °C) |
|||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK |
Bezogen auf die einatembare Fraktion:
|
|||||||||||||||||||||
| Toxikologische Daten |
|
|||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Atrazin ist der Trivialname eines Herbizids aus der Familie der Chlortriazine. Einige Handelsnamen sind Aatrex, Aktikon, Alazine, Atred, Atranex, Atrataf, Atratol, Azinotox, Crisazina, Farmco Atrazine, G-30027, Gesaprim, Giffex 4L, Malermais, Primatol, Simazat, Weedex, Zeapos und Zeazin.
Inhaltsverzeichnis
Geschichte
Atrazin wurde 1958 von Ciba-Geigy (heute Syngenta) unter dem Handelsnamen Gesaprim als systemisches Triazin-Herbizid eingeführt.
Ab dem 31. Oktober 1986 gelangten etwa 0,4 Tonnen Atrazin über die Abwässer des Unternehmens Ciba-Geigy in den Rhein, was zusammen mit dem Grossbrand von Schweizerhalle des Sandoz-Konzerns bei Basel einen Tag später ein Fischsterben im Rhein auslöste.
Gewinnung und Darstellung
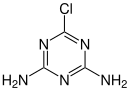
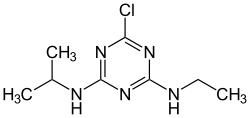
Die kommerzielle Herstellung von Atrazin (5) erfolgt durch eine stufenweise Umsetzung von Cyanurchlorid (1) mit Ethylamin (2), wobei zunächst als Zwischenprodukt Etatryn (3) entsteht. Dieses wird anschließend mit Isopropylamin (4) zum Atrazin umgesetzt.
Der dritte Chlorsubstituent ist weniger leicht substituierbar und verbleibt im Molekül.
Bei Abbaureaktionen beginnt hier der langsame hydrolytische Abbau, sehr viel schneller als Wasser reagieren nucleophile NH- oder SH-Funktionen von Peptiden.
Verwendung und Wirkungsweise
Wo die Verwendung von Atrazin noch zugelassen ist, wird es zur Bekämpfung von ein- und zweikeimblättrigen Unkräutern speziell im Mais-, aber auch Spargel-, Kartoffel- und Tomatenanbau eingesetzt. Die Wirkung von Atrazin beruht auf Hemmung der Photosynthese von Pflanzen. Es bindet an das Chinon QB (das dritte Glied der Elektronentransportkette im Photosystem II nach Phäophytin und QA) und unterbricht so den Elektronentransport.
Umweltverhalten
Atrazin wird in der Umwelt nur relativ langsam durch Hydrolyse abgebaut, wobei im ersten Schritt Hydroxyatrazin entsteht.
Daneben wird Atrazin auch mikrobiell abgebaut, die wichtigsten Abbauprodukte des mikrobiellen Abbaues sind: Desethylatrazin, Desisopropylatrazin, Didesalkylatrazin und Hydroxyatrazin.
Atrazin ist für Organismen unterschiedlich schädlich. Es kann schon in sehr geringen Konzentrationen die Entwicklung von männlichen Fröschen stören und diese in Zwitter verwandeln. Untersuchungen von Hayes und anderen Autoren zufolge steht Atrazin aber nicht nur im Verdacht, die Testosteron-Produktion zu senken, sondern auch die Östrogen-Produktion zu stimulieren und damit die Entwicklung von Brustkrebs beim Menschen zu begünstigen.
Für Vögel und Nützlinge (z. B. Bienen) sowie für Bodenlebewesen ist der Wirkstoff weitgehend ungefährlich. Atrazin reichert sich in der Nahrungskette nur geringfügig oder nicht an.
Regulierung
Da Atrazin und sein Hauptabbauprodukt Desethylatrazin auch ins Grundwasser gelangen und damit dann auch im Trinkwasser nachgewiesen werden können, ist die Anwendung von Atrazin seit 1. März 1991 in Deutschland und seit 1995 in Österreich verboten. Es ist jedoch trotzdem noch immer in der Umwelt weit verbreitet; nach dem Elbhochwasser 2002 beispielsweise wurde es ausgeschwemmt und konnte später vor Helgoland vermehrt nachgewiesen werden, so in Miesmuscheln und den Lebern von Flundern.
EU
In der Europäischen Union ist der Einsatz von Atrazin seit 2003 verboten. Die erlaubte Tagesdosis beträgt 0,02 und die akute Referenzdosis 0,1 Milligramm pro Kilogramm Körpergewicht und Tag.
Deutschland
In Deutschland ist die Anwendung von Atrazin seit dem 1. März 1991 verboten. Der Gehalt von Pestiziden im Grundwasser darf maximal 0,1 µg/l betragen. Nach Grenzwertüberschreitung gilt – bei einem erfolgversprechenden Sanierungsplan – ein Ausnahmegrenzwert von 3 µg/l.
Schweiz
In der Schweiz wurde Atrazin per Anfang 2007 aus dem Anhang 1 („Für die Verwendung in Pflanzenschutzmitteln genehmigte Wirkstoffe“) der Pflanzenschutzmittelverordnung gestrichen, so dass die Verwendung von Atrazin-haltigen Pflanzenschutzmitteln seit 2012 verboten ist. Seither gehen die im Grundwasser gefundenen Konzentrationen tendenziell zurück. Der Export von Atrazin ist seit dem 1. Januar 2021 verboten.
USA
Die US-amerikanische Umweltbehörde EPA vertrat zuletzt 2007 die Auffassung, dass es keine ausreichenden Hinweise auf Schädigung von Amphibien gebe. Seit 2010 wurde in Zusammenhang mit gehäuften Atrazin-Funden im Trinkwasser des Corn Belt eine umfassende Neubewertung auf Grund seit 2007 veröffentlichter Forschungsergebnisse durchgeführt. Im November 2020 veröffentlichte die EPA schließlich eine Bewertung, der zufolge Atrazin wahrscheinlich mehr als 1.000 der am stärksten gefährdeten Pflanzen und Tiere der USA schadet. Nur zwei Monate zuvor hatte die Behörde das Pestizid für weitere 15 Jahre zugelassen.
Resistenzen
Unter anderem bei den Pflanzen Weißer Gänsefuß, Gemeine Melde und Einjähriges Rispengras sind Resistenzen gegen Atrazin und andere Wirkstoffe aus der Klasse der Triazine bekannt. Diese beruhen auf einer Punktmutation im psbA-Gen des plastidären Genoms, welches das Bindeprotein für QB codiert. An Position 264 des Peptids fand ein Aminosäureaustausch von Glycin nach Serin statt, wodurch die Bindungsaffinität des Proteins an Triazinherbizide stark herabgesetzt wird.