
Chemiosmotische Kopplung

X + H+(außen) → Y + H+(innen)

Als Chemiosmotische Kopplung oder auch Chemiosmose bezeichnet man einen Mechanismus, bei dem Transportvorgänge an Biomembranen mit zentralen chemischen Stoffwechselprozessen gekoppelt sind.
Auf einem chemiosmotischen Vorgang basiert die mit Abstand wichtigste Reaktion zur Regeneration des Energieträgers ATP aus ADP + Pi
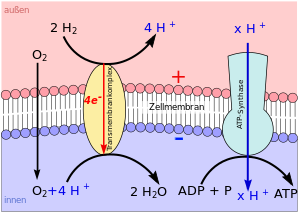
Diese endergonische Reaktion wird durch das Enzym ATP-Synthase katalysiert, das in eine elektrisch geladene Biomembran eingebettet ist. Die elektrochemische Kraft des Ionengradienten, der zwischen der Innen- und Außenseite der Membran vorliegt, wird von dem Enzym zum Aufbau der energiereichen Tri-Phosphat-Bindung des ATP genutzt (vgl. Abb. 1).
Auf dieser Kraft beruht auch eine Reihe weiterer biologischer Vorgänge. So sind viele exergone Reaktionen chemiosmotisch an den Aufbau des elektrischen Felds der Biomembran gekoppelt (vgl. Abb. 2).
Inhaltsverzeichnis
Entstehung der Chemiosmotischen Theorie und der verwendeten Begriffe
Ohne ATP bricht jeder bekannte Stoffwechsel zusammen und der Organismus stirbt. Andererseits kann ATP nicht in nennenswerter Menge gespeichert werden und muss in den Zellen ständig aus ADP regeneriert werden. Im menschlichen Körper wird jedes ATP-Molekül pro Tag ca. 3000 mal aus ADP wiedergewonnen und verbraucht. Seit Mitte des 20. Jahrhunderts war bekannt, dass beim Menschen die Hauptmasse des ATP durch die Oxidation von NADH regeneriert wird. Jahrelang war erfolglos nach einer Substanz gesucht worden, die als energiereiches Zwischenprodukt die Kopplung der NADH-Oxidation mit der ATP-Bildung bewirkt.
1961 schlug Peter D. Mitchell ein chemiosmotisches Modell (auch bekannt als Mitchell-Hypothese) vor. Er bestritt, dass die NADH-Oxidation mit der ATP-Synthese durch ein Zwischenprodukt gekoppelt ist. Seine Hypothese:
- Für die Kopplung ist ein elektrochemisches Potenzial an der Mitochondrien-Membran verantwortlich.
- Der außerhalb dieser Membran liegende Raum hat eine höhere Konzentration von H+-Ionen als die innerhalb liegende Matrix. Daher stammt die Bezeichnung Protonengradient.
- Die NADH-Oxidation geschieht in einer Elektronentransportkette, die als nach außen gerichtete „Protonenpumpe“ fungiert. Diese Protonentranslokation produziert eine
- Proton Motive Force ΔP (Abk. PMF, deutsch: Protonen bewegende Kraft). Die Energie der zurückfließende Protonen liefert die Energie für den von der ATP-Synthase katalysierten Prozess.
- Elektronentransportphosphorylierung ist die Bezeichnung für den Gesamtprozess, bei dem eine Elektronentransportkette die Energie für die Phosphorylierung von ADP zu ATP liefert.
1978 wurde Mitchell für die Entdeckung der chemiosmotischen Kopplung mit dem Nobelpreis für Chemie ausgezeichnet. Auch Jahre später hielt sich gegenüber der „Mitchell-Hypothese“ noch eine deutliche Skepsis, auch in Lehrbüchern. Inzwischen ist unbestritten, dass die Chemiosmotische Kopplung nicht nur bei Tieren und Pflanzen (in den Mitochondrien und den pflanzlichen Chloroplasten), sondern auch bei nahezu allen Mikroorganismen eine zentrale Rolle im Stoffwechsel spielt.
In der älteren Literatur noch als chemiosmotische Hypothese benannt, gilt die „allgemeine chemiosmotische Theorie“ heute als allgemein anerkannt.
Aufbau und Aufrechterhaltung des Membranpotenzials
Aufbau und Aufrecht-Erhaltung des Membranpotenzials beruhen auf dem Export von Kationen zur Außenseite der Biomembran. Der Export erfordert Energie, da die Ionen gegen ein Ladungs- und Konzentrationsgefälle transportiert werden müssen.
Die Energie des Membranpotentials ist für die Zelle lebensnotwendig. Werden seine elektrische Spannung und die Konzentrationsunterschiede der Ionen zwischen Innen- und Außenseite nicht ausreichend regeneriert, bricht die ATP-Versorgung der Zelle zusammen und sie „verhungert“. Das geschieht auch, wenn die strukturelle Integrität der Membran Schaden nimmt. Jedes Loch führt zum lebensbedrohlichen „Kurzschluss“. Membranen von lebenden Zellen sind stets geschlossene Kompartimente.
Fast alle Organismen nutzen den Export von H+. Dieser Export wird als Protonentranslokation bezeichnet und geschieht durch sogenannte Protonenpumpen.
pH-Gradienten treten in der Biologie an Membranen von Zellen und Zellorganellen (Mitochondrien und Chloroplasten) auf. pH-Gradienten an Membranen sind essentiell für den Energiestoffwechsel aller bekannter Organismen. Diese Gradienten sind nicht statisch, sondern befinden sich in einem quasistationären Fließgleichgewicht. Dabei werden Protonen aktiv gegen das Konzentrationsgefälle gepumpt (Protonenpumpe), während gleichzeitig das Potential des Gradienten energetisch genutzt wird. Der Gesamtprozess wird gelegentlich auch Protonenfluss genannt.
Die Energie zum Aufbau des Membranpotenzials stammt entweder aus der Differenz der Redoxpotentiale bei der Oxidation energiereicher Stoffe (oxidative Phosphorylierung) oder aus der Lichtenergie (Photophosphorylierung).
| Organismus oder Organell | Außen | Innen | Energiequelle |
|---|---|---|---|
| Archaea | Extrazellularraum | Cytoplasma | Redoxpotential/Licht |
| Bakterien | Periplasma | Cytoplasma | Redoxpotential/Licht |
| Chloroplasten in Pflanzen | Thylakoid-Innenraum | Stroma | Redoxpotential/Licht |
| Mitochondrien in Eukaryoten | Intermembranraum | Matrix | Redoxpotential |
Oxidative Phosphorylierung
In der Atmungskette der Mitochondrien können mehrere Proteinkomplexe als Protonentransporter fungieren: Dies sind neben der NADH-Dehydrogenase (Komplex I), die Cytochrom-c-Reduktase (Komplex III) (über den Q-Zyklus), sowie die Cytochrom-c-Oxidase (Komplex IV). Die Energie stammt aus der hohen Redoxpotentialdifferenz vom NADH beziehungsweise FADH2 zum Sauerstoff. Eine Verstärkung des Gradienten erfolgt durch den Verbrauch von Protonen bei der Bildung von Wasser aus Sauerstoff und Protonen durch die Cytochrom-c-Oxidase.
Bei chemotrophen Prokaryoten wurde eine Vielzahl von Elektronentransportketten gefunden, die als Protonenpumpen fungieren. Die ATP-Generierung bei chemo-litho-trophen Organismen beruht in der Regel darauf, dass die Elektronentransportkette von einem außen oxidierten Stoff zu einem innen reduzierten Oxidationsmittel verläuft.
Die Oxidative Phosphorylierung ist auch bei anaeroben, chemotrophen Organismen weit verbreitet (Anaerobe „Atmung“). Viele dieser Organismen nutzen unter Sauerstoffmangel einen alternativen Stoffwechselweg, nämlich die Substratkettenphosphorylierung. Sie beruht nicht auf dem Chemiosmotischen Mechanismus und findet im Cytoplasma statt.
Photophosphorylierung
Phototrophe Bakterien und einige Archaea regenerieren ATP ebenfalls durch Elektronentransportketten, in denen Membranproteine als Protonenpumpen fungieren. Bei schwefelfreien Purpurbakterien erfüllt unter anaeroben Bedingungen ein Cytochrom-''bc''1 diese Funktion. Energielieferant ist hier Licht, das über einen Lichtsammelkomplex einen zyklischen Elektronentransport antreibt.
Bei der oxygenen Photosynthese von grünen Pflanzen und Cyanobakterien fungiert der Cytochrom-b6f-Komplex (Cyt b6f) der Redoxkette als Protonenpumpe.
- Die Energie stammt zunächst aus dem Redoxpotential der Elektronen, die bei der acyclischen ATP-Bildung vom Photosystem II (PS II) zum Photosystem I (PS I) durch die Redoxkette transportiert werden. Die Energie der Elektronen stammt aus der Anregung durch das Licht im Photosystem II.
- Bei der zyklischen Phosphorylierung werden Elektronen im Photosystem I durch Licht angeregt und über Ferredoxin zurück auf das Cytochrom b6 übertragen.
Der Protonengradient wird dadurch verstärkt, dass auf der Seite des Thylakoid-Innenraums die Spaltung des Wassers zu Sauerstoff und Protonen erfolgt, also die Protonenkonzentration zusätzlich erhöht wird. Auf der Seite des Stromas wird NADPH unter Verbrauch von Protonen gebildet.
Schließlich können Haloarchaea Lichtenergie durch Bacteriorhodopsin direkt nutzen, um ein Membranpotential aufzubauen. Diesem sehr einfachen Mechanismus liegt im Unterschied zu allen bisher geschilderten Mechanismen keine Redoxkette zu Grunde.
ATP-Synthase als Protonenpumpe
Selbst in anaeroben Organismen, die ATP nicht nach dem Chemiosmotischen Mechanismus, sondern durch Substratkettenphosphorylierung gewinnen, findet sich das Enzym ATP-Synthase. Allerdings dient es bei diesen Organismen selbst als Protonenpumpe zur Aufrechterhaltung eines im Zellinneren benötigten pH-Werts. Zudem nutzen auch diese Lebewesen die Energie ihres Membranpotenzials für zahlreiche Prozesse.
Energetisierung von Membranen
Die Doppellipidschicht von Biomembranen ist aufgrund ihrer chemischen Struktur – in ihrem Inneren befinden sich hydrophobe (wasserunlösliche und -abweisende) Molekülketten – für Wasser und Ionen wie H3O+ undurchlässig. Dadurch bildet sie eine Barriere für den spontanen Ausgleich eines zwischen beiden Seiten der Membran bestehenden pH-Unterschiedes.
An der Außenseite der Doppellipidschicht befinden sich die hydrophilen „Köpfe“ der Moleküle. Beispiele für Membran-Lipide sind Glycolipide und Phospholipide. Speziell die Köpfe der Phospholipide sind amphoter, können also positive oder negative Ladungen aufnehmen.
Gegenüber Änderungen des pH-Werts wirken diese Molekülgruppen als Puffer. Negativ geladene Phosphat-Gruppen können bei niedrigem pH-Wert „protoniert“ werden und sind als Phosphorsäurereste nicht mehr negativ geladen. Im alkalischen Bereich können -NH3+-Gruppen in neutrale -NH2-Aminogruppen umgewandelt werden.
Bei einer Differenz des pH-Werts befinden sich auf beiden Seiten der Membran unterschiedliche elektrische Ladungen, positiv in saurer Umgebung und umgekehrt. Biomembranen können daher wie ein Kondensator elektrische Energie in Form des Membranpotentials speichern.
Spannung und Energiegehalt eines Protonengradienten
Die Kraft des Protonengradienten ΔP an einer biologischen Membran setzt sich zusammen aus zwei Komponenten, einer chemischen und einer elektrischen. Der Zusammenhang zwischen Protonengradienten und Energiegewinnung in einer Zelle wird durch die chemiosmotische Theorie von Peter D. Mitchell (1961) beschrieben. Möglicherweise ist die Nutzung von Protonengradienten an Biomembranen aus der Nutzung geologischer Protonengradienten entstanden, z. B. an schwarzen Rauchern.
- Dem Konzentrationsunterschied an H+-Ionen ΔpH.
- Der Spannung an der Membran, Membranpotential ΔΨ:
ΔP = ΔΨ − Z × ΔpH
(Z = 2,3 R T / F. Letztere Formel besagt ungefähr: Protonengradient und der Membran-Ladung addieren sich temperaturabhängig, da sie ansonsten nur über eine Konstante, nämlich dem Quotionten aus Universeller Gaskonstante und Faraday-Konstante zusammenhängen.)
Der Zusammenhang zwischen dem Protonengradienten ΔP und der elektrochemischen Potentialdifferenz bezüglich der Protonen Δ
ΔP × F = −Δ
H+
Beispiel:
- Wenn E. coli Bakterien bei einem pH-Wert von 6 wachsen und dabei im Zellinneren einen pH-Wert von 7,8 aufweisen, misst man an ihrer Membran eine elektrische Spannung von −95 mV. Nach letzterer Gleichung hat ihr Protonengradient, der für biologische Prozesse genutzt werden kann, dann insgesamt −200 mV. Dieser Wert ist enorm, zumal die isolierende Membran nur ca. 2 nm dick ist.
Nutzung des Membranpotenzials
Die mit Abstand wichtigste Nutzung des Membranpotenzials findet, wie oben beschrieben, bei der Regeneration von ATP statt. Daneben gibt es noch eine Reihe anderer Prozesse, die den pH-Gradienten nutzen.
Reverser Elektronentransport bei Chemolithotrophen Prokaryoten
Chemolithotrophe Organismen müssen NADH mit schwachen Reduktionsmitteln regenerieren. Es wurde lange diskutiert, ob für diese endergone Reaktion ATP aufgewendet werden muss. Tatsächlich hat sich gezeigt, dass für diesen „reversen Elektronentransport“ direkt das Membranpotenzial genutzt werden kann.
Protonengradient, Entkoppler und Thermogenese
Neugeborene und Winterschlaf haltende Säugetiere können im braunen Fettgewebe direkt Wärme aus dem Protonengradienten gewinnen. Dazu benutzen sie sogenannte Entkoppler, die den (geregelten) Einstrom von H+-Ionen ins Innere der Mitochondrien ermöglichen, ohne ATP aus ADP zu generieren. Diese Umgehung der ATP-Synthese ermöglichen UCP-Proteine (uncoupling proteins) wie Thermogenin. Sie entkoppeln die Atmungskette von der ATP-Synthese, daher der Name Entkoppler.
In der Biochemie sind Entkoppler schon lange bekannt. Als die Atmungskette erforscht wurde, kam z. B. 2,4-Dinitrophenol (DNP) zur Anwendung. Wie andere chemische Entkoppler basiert die Funktion von DNP auf dem Zusammenbruch des pH-Gradienten. Die DNP-Moleküle lösen sich im lipophilen Inneren der Membran. An der Membran-Innenseite geben sie H+ ab, diffundieren an die Außenseite und nehmen dort wieder H+ auf.
Protonengradient und Geißelbewegung
Auch die bakterielle Fortbewegung durch Geißeln (Flagellen) beruht – wie bei der ATP-Synthase – auf einer Protonen getriebenen Drehbewegung. Wie bei der ATP-Synthase funktioniert der Motor nicht nach dem Prinzip einer Turbine. Vielmehr bewirkt der Protonenfluss eine Kraft zwischen dem sich drehenden Rotor und Proteinen, die in der Zellwand fest verankert sind und als Stator fungieren. Im Gegensatz zur ATP-Synthase ist der molekulare Mechanismus des Geißel-Motors aber noch nicht im Detail aufgeklärt.
Der Antrieb der Geißeln erfolgt durch einen Basalkörper, der in der Zellwand verankert ist. Neben dem eigentlichen Motor gehören dazu noch ringförmige Proteine, die die Funktion eines Drehlagers erfüllen. Die Geißel selbst wird passiv bewegt, etwa wie bei einer Rührmaschine.
Die Effizienz dieser Maschine ist beachtlich. Der protonengetriebene, natürliche „Nanomotor“ erreicht bei manchen Organismen 100.000 Umdrehungen pro Minute.
Alkaliphile Organismen
Alkaliphile Bakterien können in Medien wachsen, die deutlich basischer sind als ihr Zellplasma. Entgegen früheren Annahmen nutzen insbesondere aerobe alkaliphile Organismen H+-getriebene ATP-Synthasen und H+-translozierende Redoxketten. Für den Aufbau eines Membranpotentials benötigen Organismen spezielle Mechanismen, da ins alkalische Medium abgegebene Protonen sofort neutralisiert würden. Bei vielen dieser Organismen werden in der Zellwand vermehrt negativ geladene Moleküle eingelagert, wodurch diese eine gewisse Barriere gegen OH−-Ionen darstellt.
Weitere Anpassungen sind in nebenstehender Abbildung am Beispiel des gramnegativen γ-Proteobakteriums Pseudomonas alcaliphila schematisch dargestellt.
Der Organismus weist mit anderen alkaliphilen Pseudomonas-Species zwei Gemeinsamkeiten auf, die sich bei neutrophilen Pseudomonaden nicht finden.
- Es finden sich bei Wachstum in stark alkalischen Nährmedien vermehrt spezielle c-Cytochrome im Periplasma. Diese fungieren nicht nur als Elektronen-Carrier von der Cytochrom-c-Reduktase (in der Abbildung Coenzym Q-Cytochrom c-Oxidoreduktase) zur Cytochrom-c-Oxidase. Vielmehr dienen sie bei hohen pH-Werten als „Kondensator“ und Carrier für Protonen, die von der Atmungskette an der Außenseite der Membran freigesetzt werden. Die Cytochrome halten die H+-Kationen vom alkalischen Medium fern und übertragen die Protonen zur ATP-Synthase. Solche c-Cytochrome wurden auch bei einigen grampositiven alkaliphilen Bakterien gefunden.
- Noch mehr bei alkaliphilen Bakterien ist ein Mechanismus verbreitet, mit dem die Organismen den pH-Wert im Plasma im von ihnen benötigten neutralen Bereich halten können. Sie besitzen in der Regel einen H+/Na+-Antiporter (links im Bild), der nach außen transloziertes H+ gegen Natrium-Kationen austauscht. Die elektrische Spannung der Membran wird dabei aufrechterhalten. Der elektrochemische Na+-Gradient an der Zellmembran wird von akaliphilen Lebewesen für eine Reihe von Prozessen genutzt, die bei anderen Organismen auf einem Protonengradienten beruhen.
Aktive Transportvorgänge
Die Energie des Membranpotenzials kann auch für aktive Transportvorgänge genutzt werden. Haben ungeladene niedermolekulare Gifte die Membran durchdrungen, können sie partiell oxidiert werden und danach aktiv aus der Zelle hinaus befördert werden.







