
Dapson
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Dapson | |||||||||||||||||||||
| Andere Namen |
|
|||||||||||||||||||||
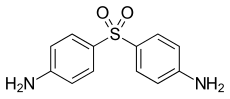
| Summenformel | C12H12N2O2S | |||||||||||||||||||||
| Kurzbeschreibung |
weißes bis gelblich weißes kristallines Pulver |
|||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 248,31 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest |
|||||||||||||||||||||
| Schmelzpunkt |
172–175 °C |
|||||||||||||||||||||
| Löslichkeit |
sehr schwer in Wasser (0,38 g·l−1 bei 37 °C) |
|||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Dapson (4,4′-Diaminodiphenylsulfon, kurz auch DADPS) ist ein antibiotisch und entzündungshemmend wirksamer Arzneistoff. Es wird zur Behandlung und Prävention von Infektionskrankheiten wie Lepra, Malaria, Actinomyceten-Infektionen und Pneumocystis jirovecii-Pneumonien bei HIV-Patienten eingesetzt. Ebenso wird es zur Behandlung chronisch entzündlicher Autoimmunerkrankungen eingesetzt, bei denen eine Gewebe-Infiltration durch neutrophile und eosinophile Entzündungszellen beobachtet wird, wie der Dermatitis herpetiformis Duhring, der Linearen IgA-Dermatose, der Subcornealen pustulösen Dermatose, dem Erythema elevatum diutinum und anderen blasenbildenden Autoimmundermatosen. Verwendet wird auch das D-N,N′ -Digalactosid.
Dapson wurde erstmals 1908 in Deutschland von E. Fromm synthetisiert und 1934 von der I.G. Farben patentiert. Es wird als Chemotherapeutikum (gegen Dermatosen und Lepra) von der Firma Riemser (Handelsname: Dapson-Fatol®) vertrieben. Da Dapson in Tabelle 2 der Verordnung (EU) Nr. 37/2010 über pharmakologisch wirksame Stoffe und ihre Einstufung hinsichtlich der Rückstandshöchstmengen in Lebensmitteln tierischen Ursprungs aufgeführt ist, ist seine Anwendung bei Lebensmittel liefernden Tieren in der Europäischen Union generell verboten.
Der antibiotische Wirkungsmechanismus erklärt sich durch die antimetabolitische Hemmung der Folsäuresynthese des Mykobakteriums. Aufgrund starker Resistenzentwicklung wird Dapson bevorzugt in Kombination mit anderen Präparaten angewandt, z. B. mit Rifampicin oder Clofazimin.
Zu den Nebenwirkungen von Dapson zählt eine dosisabhängige Hämolyse und Methämoglobinämie, vor allem bei Glucose-6-Phosphat-Dehydrogenase-Mangel.
Technisch wird Dapson als Härter für Epoxidharze (für heißhärtende temperaturbeständige Systeme) und zur Herstellung von Polyimiden verwendet.
Dapson-Hypersensibilitätssyndrom
Bei der Anwendung von Dapson kommt es bei 0,5–3,6 % der Patienten nach 4–6 Wochen nach Therapiebeginn zu einer Hypersensitivitätsreaktion, die erstmals 1949 bei Leprapatienten in Nigeria beschrieben und 1951 erstmals als Dapson-Hypersensibilitätssyndrom benannt wurde. Hierbei handelt es sich um eine schwere idiosynkratische Nebenwirkung mit Fieber, Hautausschlag und Beteiligung weiterer Organsysteme, vorwiegend der Leber und des blutbildenden Systems bis hin zu deren Versagen. Die Letalität beträgt 9,9 %.
In einer chinesischen genomweiten Assoziationsstudie konnte mit dem HLA-B*13:01-Allel des humanen Leukozytenantigen-Systems ein genetischer Risikofaktor für das Hypersensitivitätssyndrom beschrieben werden, der mit einer Odds-Ratio von 20,53 verbunden ist. Da sich dieses Allel in 2–20 % in China, in 1,5 % in Japan, in 1–12 % in Indien und in 2–4 % in Südostasien findet, jedoch kaum in Europa oder Afrika, wird die Entwicklung eines Gentests empfohlen, um die betroffenen Bevölkerungsgruppen vor Behandlungsbeginn mit Dapson auf das HLA-B*13:01-Allel zu testen.
Risikobewertung
Dapson wurde 2014 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Dapson waren die Besorgnisse als potentieller endokriner Disruptor. Die Neubewertung fand ab 2016 statt und wurde von Deutschland durchgeführt. Der Abschlussbericht wurde 2017 veröffentlicht und kam zu dem Ergebnis, dass keine Notwendigkeit für regulatorische Folgemaßnahmen auf EU-Ebene in Bezug auf die Umwelt besteht und keinerlei Einschränkungen oder andere Maßnahmen durchgeführt werden müssen.