Glutamat-Decarboxylase
| Glutamat-Decarboxylase | ||
|---|---|---|
| ||
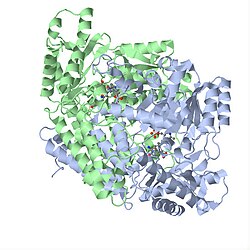
| GAD67 nach PDB 2okj | ||
| Masse/Länge Primärstruktur | 594 / 585 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homodimer | |
| Kofaktor | Pyridoxalphosphat | |
| Isoformen | GAD25, GAD65, GAD67 | |
| Bezeichner | ||
| Gen-Name(n) | GAD1, GAD2 | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 4.1.1.15, Lyase | |
| Reaktionsart | Decarboxylierung | |
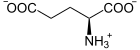
| Substrat | L-Glutamat | |
| Produkte | γ-Aminobutyrat + CO2 | |
| Vorkommen | ||
| Übergeordnetes Taxon | Eukaryoten | |
Glutamat-Decarboxylase (GAD) ist ein Enzym in Eukaryoten, das die Decarboxylierung von Glutamat zu γ-Aminobuttersäure (GABA) und CO2 katalysiert. Dies ist der einzige Weg zur Biosynthese des Neurotransmitters GABA. Als Co-Faktor verwendet die Glutamat-Decarboxylase Pyridoxalphosphat. Im Mensch sind zwei Gene bekannt, die für Enzyme mit dieser Aktivität codieren: GAD1 und GAD2. Mutationen im GAD1-Gen können zum Enzymmangel im Gehirn, und dieser zu spastischer tetraplegischer Zerebralparese Typ 1 (CPSQ1), führen.
In Säugetieren existiert die Glutamat-Decarboxylase in zwei Isoformen GAD67 und GAD65, die von den beiden Genen GAD1 und GAD2 codiert werden. Beide Gene werden in Zellen im Gehirn exprimiert. Zudem wird GAD2 auch in der Bauchspeicheldrüse exprimiert. Mindestens zwei weitere Formen GAD25 und GAD44 ohne Enzymaktivität wurden in sich entwickelnden Gehirnen bei Embryonen entdeckt.
Inhaltsverzeichnis
Katalysierte Reaktion
Glutamat wird zu GABA decarboxyliert. Weitere Substrate der Isoform im Gehirn: L-Cysteat, 3-Sulfino-L-alanin und L-Asparaginsäure.
Antikörper gegen GAD
Glutamat-Decarboxylase-Antikörper gegen die Isoform 65 sind zu Beginn der Erkrankung bei 50–70 % der Typ-I-Diabetiker nachweisbar. Insbesondere beim Erwachsenen mit neu aufgetretener Zuckerkrankheit dienen sie dazu, frühzeitig einen Typ-2 von einem Typ-1-Diabetes zu unterscheiden (siehe auch LADA = latent autoimmune diabetes in adults).