
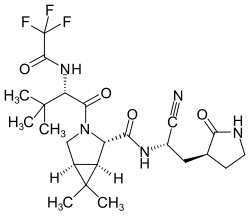
Nirmatrelvir
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Nirmatrelvir | |||||||||||||||
| Andere Namen |
|
|||||||||||||||
| Summenformel | C23H32F3N5O4 | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||
| Wirkmechanismus |
Hemmung der viralen 3C-like-Protease (3CLpro) |
|||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 499,53 g·mol−1 | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Nirmatrelvir (Entwicklungsname: PF-07321332) ist eine niedermolekulare chemische Verbindung mit antiviraler Wirkung zur Behandlung von COVID-19. Die Substanz wirkt als Proteaseinhibitor und hemmt in vitro das Enzym 3-Chymotrypsin-like Protease (3CLpro), das zu den wichtigsten in Coronaviren vorkommenden Endopeptidasen zählt.
Nirmatrelvir wurde – in Kombination mit Ritonavir, unter dem Handelsnamen Paxlovid – von dem Pharmaunternehmen Pfizer klinisch entwickelt. Am 22. Dezember 2021 erhielt das Kombinationsmedikament in den USA eine Notfallzulassung, am 31. Dezember 2021 in Großbritannien und am 28. Januar 2022 in der EU eine (zunächst bedingte) Zulassung. Es ist das erste zugelassene COVID-19-Mittel, das oral verabreicht werden kann.
Inhaltsverzeichnis
Eigenschaften
Im April 2021 stellte Pfizer das Molekül auf einer Tagung der American Chemical Society vor. Die Struktur enthält als biologisch aktiven Teil („warhead“) eine Nitrilgruppe, die mit dem Cystein-Rest der katalytischen Diade im aktiven Zentrum der 3CLpro reagiert. Die Struktur wurde durch entsprechende chemische Modifikationen für eine orale Verabreichung optimiert. Die orale Gabe als Kapsel oder Tablette ermöglicht die Behandlung von SARS-CoV-2-Infizierten in der Frühphase, wenn die Viruslast besonders hoch ist, aber noch kaum Symptome auftreten und eine Hospitalisierung nicht oder noch nicht erforderlich ist.
In den bisherigen klinischen Studien wird Nirmatrelvir zusammen mit einer geringen Dosis des bereits für die antiretrovirale Therapie zugelassenen HIV-Proteaseinhibitors Ritonavir verabreicht. Die gleichzeitige Verabreichung trägt dazu bei, den Abbau von Nirmatrelvir zu verlangsamen, damit es im Körper für längere Zeit in höheren Konzentrationen aktiv bleiben kann, um so die Bekämpfung des Virus zu unterstützen. Ritonavir ist ein Inhibitor des Cytochrom-P450-Systems in der Leber.
Hintergrund
Die 3-Chymotrypsin-like protease (3CLpro; auch: Nichtstrukturprotein 5, nsp5) ist beteiligt an der posttranslationalen Verarbeitung verschiedener Polypeptide und an der Produktion von 16 Nichtstrukturproteinen des SARS-CoV-2 („Corona-Virus“). Diese Nichtstrukturproteine spielen eine grundlegende Rolle bei der Replikation, Transkription und Virusrekombination während einer Infektion. Die Hemmung von Proteasen blockiert die Freisetzung von Nichtstrukturproteinen und unterdrückt die Reifung und Infektiosität von SARS-CoV-2. Infolgedessen ist 3CLpro als Hauptprotease von SARS-CoV-2 ein attraktives Ziel für die Entwicklung antiviraler Wirkstoffe gegen COVID-19.
Klinische Prüfung
In drei ersten Phase-1-Studien wurde PF-07321332 ausschließlich intravenös verabreicht, ebenso in einer Phase-3-Studie mit hospitalisierten Patienten (250 mg pro Tag über 5 Tage). Von Juli bis September 2021 wurden drei Phase-3-Studien aufgelegt, in denen nicht hospitalisierte mit SARS-CoV-2 Infizierte PF-07321332 in Kombination mit Ritonavir als orale Gabe erhalten (alle 12 Stunden für fünf Tage):
- EPIC-HR (Evaluation of Protease Inhibition for COVID-19 in High-Risk Patients),
- EPIC-SR (Evaluation of Protease Inhibition for COVID-19 in Standard-Risk Patients) und
- EPIC-PEP (Evaluation of Protease Inhibition for COVID-19 in Post-Exposure Prophylaxis)
EPIC-HR
Am 5. November 2021 veröffentlichte Pfizer erste Ergebnisse der Studie EPIC-HR. Danach hat Nirmatrelvir/Ritonavir „bei den meisten ambulanten Risikopatienten mit kurzer Symptomdauer einen schweren Verlauf mit Hospitalisierung oder Tod verhindert“. In der Patientengruppe, die innerhalb von drei Tagen nach dem Auftreten von Symptomen PF-07321332 in Kombination mit Ritonavir erhielt, wurde nur bei 3 von 389 Patienten (0,8 %) eine Hospitalisierung notwendig. In der Placebogruppe mit 385 Patienten dagegen waren es 27 Patienten (7,0 %). Während es in der Verumgruppe keinen Todesfall gab, waren es in der Placebogruppe sieben. Bei einem zweiten Studienarm, der die Behandlung mit PF-07321332 bzw. Placebo auf bis zu 5 Tage nach Beginn erster Symptome erweiterte, gab es in der Verumgruppe ebenfalls keinen Todesfall und in der Placebogruppe zehn. Nur 6 von 607 Patienten (1,0 %) in der Verumgruppe mussten hospitalisiert werden, in der Placebogruppe 41 von 612 (6,7 %).
Im Dezember 2021 informierte Pfizer, dass die finalen Daten der EPIC-HR-Studie mit 2246 erwachsenen Hochrisikopatienten die Zwischenergebnisse vom November bestätigten: Demzufolge senkt die fünftägige Gabe von Paxlovid (Nirmatrelvir + Ritonavir) beginnend innerhalb von drei Tagen nach Symptombeginn das Risiko eines Krankenhausaufenthalts im Vergleich zu Placebo um 89 %. Begann die Behandlung innerhalb von fünf Tagen nach Symptombeginn (sekundärer Endpunkt), so war das Risiko eines Krankenhausaufenthalts um 88 % gegenüber Placebo erniedrigt. In beiden Studienarmen trat kein Todesfall in der Verumgruppe auf. In der Patientengruppe im Alter von 65 Jahren oder älter, einer der Bevölkerungsgruppen mit dem höchsten Risiko für Krankenhausaufenthalt oder Tod, betrug die relative Risikoreduktion für eine Krankenhauseinweisung 94 %. In der EPIC-HR-Studie wurde auch eine starke Reduktion der Viruslast, die an 499 Patienten untersucht wurde, festgestellt. Auch gegen die neue Omikron-Variante soll das Medikament wirksam sein.
Nebenwirkungen
Aus den Studien ergaben sich als mögliche Nebenwirkungen von Paxlovid ein beeinträchtigter Geschmackssinn, Durchfall, Bluthochdruck und Muskelschmerzen (Myalgien). Die Anwendung von Paxlovid bei Menschen mit unkontrollierter oder nicht diagnostizierter HIV-1-Infektion kann zu einer HIV-1-Arzneimittelresistenz führen. Ritonavir kann zudem Leberschäden verursachen.
EPIC-SR
Ferner berichtete Pfizer im Dezember 2021 auch über Zwischenergebnisse aus der laufenden EPIC-SR-Studie, in der Paxlovid an ungeimpften COVID-19-Patienten mit Standardrisiko (d. h. geringem Risiko für Krankenhausaufenthalt oder Tod) sowie an geimpften COVID-19-Patienten mit Risikofaktoren für einen schweren Verlauf untersucht wird. Hier vermochte das Mittel Krankenhauseinweisungen um 70 % (sekundärer Endpunkt) zu reduzieren. Ebenso wie bei der EPIC-HR-Studie wurde eine stärkere Verminderung der Viruslast beobachtet als in der Placebogruppe. Der neue primäre Endpunkt – selbstberichtete, anhaltende Linderung aller Symptome an vier aufeinanderfolgenden Tagen im Vergleich zu Placebo – wurde hingegen nicht erreicht.
Rebound-Effekt
Bei einigen Probanden wurde im Anschluss an eine Behandlung, nach einem zunächst negativen Virustest und zwischen zwei und acht Tagen nach der anfänglichen Genesung, in Nasen-Rachen-Abstrichen ein erneuter Anstieg von SARS-CoV-2-RNA oder ein Wiederauftreten von COVID-19-Symptomen beobachtet („Rebound“). Er stand nicht in Zusammenhang mit schweren Verläufen. Rebound-Effekte traten ebenfalls in der Placebo-Gruppe auf.
Auch im klinischen Alltag wurde nach der Behandlung mit Paxlovid wiederholt ein Rebound-Effekt beobachtet. Bei den betroffenen Patienten trat einige Tage nach Ende der Behandlung erneut die typische COVID-19-Symptomatik auf und es kam zu einem erneuten Anstieg der Viruslast mit positivem PCR-Test. Unter den Betroffenen waren auch geimpfte und geboosterte Patienten.
Der Verlauf der Erkrankung im Falle eines Rebound ist in der Mehrheit der gemeldeten Fälle mild und bedarf meist keiner weiteren Behandlung, jedoch liegen hierzu nur wenige Daten vor. Deshalb hat die amerikanische Zulassungsbehörde FDA den Hersteller Pfizer mit einer weiteren Studie als Bedingung für die Zulassung von Paxlovid beauflagt. Diese randomisierte kontrollierte Studie wird mit Patienten durchgeführt, die nach einer Behandlung mit Paxlovid einen Rebound erleiden, um insbesondere eine nachfolgende, zweite Gabe von Paxlovid zu untersuchen. Die Ergebnisse der Studie sollen im September 2023 vorgelegt werden.
Zulassungsstatus
Die Europäische Arzneimittelagentur (EMA) gab am 16. Dezember 2021, nachdem Pfizer die endgültigen Daten einer klinischen Studie zur Wirksamkeit der Arzneimittelkombination Paxlovid (bestehend aus Nirmatrelvir-Tabletten mit 150 mg und Ritonavir-Tabletten mit 100 mg Wirkstoff) vorgestellt hatte, eine Handreichung zum Einsatz von Paxlovid heraus. Diese sollte den Einsatz des Medikaments erleichtern, bereits bevor es offiziell zugelassen sei. Demzufolge konnten die Tabletten „zur Behandlung von Erwachsenen mit COVID-19 eingesetzt werden, die keinen zusätzlichen Sauerstoff benötigen und bei denen ein erhöhtes Risiko eines schweren Krankheitsverlaufs besteht“.
Das offizielle Zulassungsverfahren für die EU begann am 10. Januar 2022. Am 28. Januar 2022 erfolgte die (zunächst noch bedingte) Zulassung, nachdem die Europäische Arzneimittelagentur am Tag zuvor eine entsprechende Empfehlung ausgesprochen hatte.
In Deutschland können Hausärzte und Pflegeeinrichtungen seit August 2022 im Bedarfsfall Paxlovid direkt an Patienten abgeben und zu diesem Zweck entsprechende Mengen (bis fünf bzw. zehn Packungen) aus der Apotheke beziehen und vorrätig halten.
Die U.S. Food and Drug Administration (FDA) erteilte am 22. Dezember 2021 eine Notfallzulassung für die Gabe von Paxlovid an Hochrisikopatienten mit nachgewiesener SARS-CoV-2 Infektion. Die USA haben bereits 10 Millionen Dosen des Medikaments bestellt; die Auslieferung soll laut Präsident Joe Biden im Frühjahr 2022 beginnen. Am 4. Januar 2022 wurde bekannt, dass die US-Regierung ihre Bestellung verdoppelt hat und für die 10 Millionen Packungen 5,3 Milliarden US-Dollar (530 $ pro Packung) bezahlte. Am 6. Juli 2022 erlaubte die FDA die rezeptfreie Abgabe von Paxlovid durch Apotheken unter der Voraussetzung, dass Patienten eine Krankenakte sowie Liste von eingenommenen Medikamenten vorlegen.
Die britische Arzneimittelbehörde MHRA ließ Paxlovid am 31. Dezember 2021 bedingt zu für den Einsatz bei Menschen über 18 Jahren mit milden bis moderaten Symptomen, die ein Risiko für einen schweren Verlauf haben.
In der Schweiz wurde Paxlovid im Juni 2022 befristet für zwei Jahre zur Behandlung erwachsener COVID-19-Patienten zugelassen.
Patentstreit
Im Juni 2022 reichte das US-amerikanische Biotechnologieunternehmen Enanta Pharmaceuticals in Bezug auf Paxlovid eine Patentverletzungsklage gegen Pfizer ein. Laut der beim Bezirksgericht von Massachusetts eingereichten Klage verstößt Paxlovid gegen das US-Patent Nr. 11.358.953, das die Patentbehörden Enanta Anfang des Monats Juni 2022 erteilt haben. Enanta behauptet, dass das so genannte '953-Patent auf der Grundlage eines im Juli 2020 eingereichten Antrags erteilt wurde, in dem die von seinen Wissenschaftlern erfundenen Coronavirus-Proteaseinhibitoren beschrieben wurden.
