
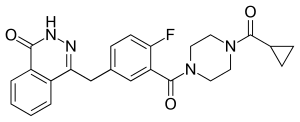
Olaparib
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Olaparib | |||||||||||||||||||||
| Andere Namen |
|
|||||||||||||||||||||
| Summenformel | C24H23FN4O3 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 434,46 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Olaparib wurde 2015 als erster Vertreter der Wirkstoffklasse der PARP-Inhibitoren zur Behandlung von Krebserkrankungen in den USA zugelassen (Handelsname: Lynparza, Hersteller: AstraZeneca).
Anwendungsgebiete (Indikationen)
Lynparza darf als Monotherapie für die Erhaltungstherapie bei erwachsenen Patienten mit Platin-sensitivem Rezidiv eines BRCA-mutierten hochgradig serösen epithelialen Eierstock-, Eileiter- oder Peritoneal-Karzinom eingesetzt werden. Vor Behandlungsbeginn muss in Blut oder Tumorgewebe eine Mutation in den Genen BRCA1 oder BRCA2 nachgewiesen sein. Im Dezember 2017 wurden auf dem San Antonio Breast Cancer Symposium (SABCS) erste Daten zur Behandlung von HER2-negativem metastasiertem Brustkrebs präsentiert. Merck (MSD) und AstraZeneca kooperieren in der klinischen Entwicklung von Olaparib. Im Januar 2018 hat die US-Arzneimittelbehörde FDA das Indikationsgebiet für Olaparib um das metastasierte Mammakarzinom mit spezifischer genetischer Mutation (BRCA-Mutation) erweitert. Im Mai 2020 folgte die Zulassungserweiterung in der Indikation Prostatakrebs. Olaparib ist auch in der EU seit 2014 zugelassen (Ovarialkarzinom), die Indikationserweiterungen erfolgten 2019 (Brustkrebs) und 2020 (Prostatakrebs, Adenokarzinom des Pankreas)
Darreichungsformen
Es sind zwei verschiedene Darreichungsformen von Lynparza (Wirkstoff: Olaparib) erhältlich, Lynparza 50 mg Hartkapseln und Lynparza 100 mg/-150 mg Filmtabletten (Stand Juni 2021). Die Dosierungsempfehlungen für die Hartkapseln und die Filmtabletten sind unterschiedlich; es besteht dadurch das Risiko einer Überdosierung mit Zunahme von unerwünschten Arzneimittelwirkungen.