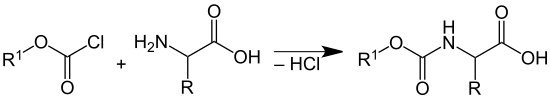Peptidsynthese
Die Peptidsynthese behandelt Verfahren zur Herstellung der biochemisch wichtigen Stoffklasse der Peptide.
Inhaltsverzeichnis
Beschreibung
Definierte Peptide können nicht durch die direkte Kondensation von Aminosäuren hergestellt werden. Bereits bei der chemischen Reaktion von zwei verschiedenen unmodifizierten Aminosäuren können vier verschiedene Dipeptide entstehen. Für eine gezielte Synthese weiterer definierter Peptide muss deshalb sowohl die Aminogruppe der einen Aminosäure als auch die Carboxygruppe der anderen Aminosäure vorübergehend jeweils durch eine geeignete Schutzgruppe blockiert werden. Außerdem ist eine Aktivierung der Carboxygruppe erforderlich, die mit der Aminogruppe der zweiten Aminosäure zur Peptidbindung reagieren soll, da Carbonsäuren mit Aminen gewöhnlich nur unter Salzbildung reagieren und keine kovalente Bindung ausbilden. Die Bildung der Peptidbindung muss unter Bedingungen erfolgen, bei denen keine Racemisierung eintreten kann, wenn enantiomerenreine Produkte entstehen sollen. Ribosomal erzeugte Peptide und Proteine bestehen – mit Ausnahme des achiralen Glycins – ausschließlich aus L-Aminosäuren. Zum Schutz der Carboxygruppe kann beispielsweise die erste Aminosäure in Gegenwart von Schwefelsäure mit Isobuten unter Bildung des Aminosäure-tert-butylesters umgesetzt werden:
In manchen Fällen, wie zum Beispiel bei Asparagin, versagt diese Methode und der tert-Butylester kann hier nur durch Umesterung mit Essigsäure-tert-butylester in Anwesenheit von starken Säuren erhalten werden.
Zum Schutz der Aminogruppe der zweiten Aminosäure wird die Aminogruppe beispielsweise mit Chlorameisensäurebenzylester (Abkürzung: Z-Cl oder Cbz-Cl; R1= Benzylgruppe), Fluorenylmethyloxycarbonylchlorid (Abkürzung: Fmoc-Cl; R1= Fluorenyl-9-methylgruppe) oder mit Di-tert-butyldicarbonat (BOC-Anhydrid) zu den entsprechenden Urethanen umgesetzt:
Nach der Knüpfung der Peptidbindung lässt sich der tert-Butylester durch Säuren wie Trifluoressigsäure unter Abspaltung von tert-Butanol hydrolysieren, wobei die Carbonsäure wieder gebildet wird. Die Spaltung der Urethane erfolgt entweder durch Umsetzung mit Chlorwasserstoff/Eisessig (Spaltung des tert-Butylurethans) durch eine Lösung von Piperidin (Spaltung von Fluorenyloxycarbonyl) oder durch Hydrogenolyse (Spaltung des Benzylurethans) jeweils unter Freisetzung der Aminofunktion.
Die Aktivierung der Carboxygruppe gelingt beispielsweise über die Umwandlung in ein Carbonsäurechlorid, ein Carbonsäureazid oder einen 4-Nitrophenylester. Besonders häufig erfolgt die Aktivierung der Carboxygruppe durch die Anwendung von Dicyclohexylcarbodiimid (DCC) als Kupplungsreagenz. Sehr gebräuchlich sind auch Aktivester von N-Hydroxybenzotriazol (HOBt), 1-Hydroxy-7-azabenzotriazol oder N-Hydroxysuccinimid (HOSu), welche entweder mit dem Kondensationsmittel N,N′-Diisopropylcarbodiimid (DIC), mit 3-Ethyl-1(N,N-dimethyl)aminopropylcarbodiimid (EDCI) oder mit HATU, HCTU,TBTU, Ethyl-2-cyano-2-(hydroxyimino)acetat (Oxyma),COMU,TOMBU oder COMBU hergestellt werden.
Eine elegante Methode zur Peptidsynthese ist die Festphasensynthese nach Merrifield. Bei der Peptidsynthese werden nach jedem Synthesezyklus die ungekoppelten Peptide mit Acetanhydrid acetyliert (englisch capping ‚bekappen‘), damit sie auch nicht in folgenden Zyklen koppeln, weil sie sonst einen Zyklus ausgesetzt hätten und fehlerhaft wären. Als Festphase werden meistens Polystyrol (PS), Polyamid, Polyethylenglykol (PEG) oder PEG-modifiziertes PS verwendet.
Die Produkte einer Peptidsynthese werden meistens anschließend gereinigt, z. B. per Fällung oder per HPLC. Durch Verwendung eines weiteren polymerisierbaren Moleküls im letzten Kopplungsschritt der Peptidsynthese können nach einer anschließenden Polymerisation die korrekt synthetisierten Peptide von den fehlerhaften und acetylierten Kopplungsprodukten abgetrennt werden.
Da die Ausbeute mit jeder gekoppelten Aminosäure sinkt, werden Proteine mit einer Länge von mehr als 70 Aminosäuren oftmals durch eine Proteinligation aus zwei oder mehreren Peptiden erzeugt.
Alternativen
Eine alternative Methode zur Peptidsynthese ist die Bailey-Peptid-Synthese. Sie basiert auf der Verwendung von NCAs als Edukte. Eine aktivierte Carboxygruppe lässt sich ebenfalls über die N-Carbonsäureanhydrid-Methode in Form von α-Aminosäure-N-carboxyanhydriden (NCAs oder Leuchs’schen Anhydriden) darstellen.
Verwendung
Synthetische Peptide dienen als Inhibitoren oder Substrate von Enzymen oder dienen als Antigene in der Immunologie.
Geschichte
Die erste Peptidsynthese erfolgte durch den Nobelpreisträger Emil Fischer, der von 1902 bis 1907 etwa 100 Peptide herstellte, von denen das längste aus 17 Aminosäuren bestand. In späteren Jahren verbesserte sein Schüler Emil Abderhalden die Peptidsynthese bedeutend. Das erste erzeugte Peptid mit Hormonwirkung war Oxytocin (ein zyklisches Nonapeptid), das 1954 von Vincent du Vigneaud synthetisiert wurde. 1955 erhielt er den Nobelpreis für Chemie für seine Arbeiten über die biochemisch bedeutsamen Schwefelverbindungen, insbesondere für die erste Synthese eines Polypeptidhormons (Oxytocin). Die ersten Synthesen von Insulin erfolgten in den Jahren 1963 bis 1966 durch Helmut Zahn, Y. Wang und Panayotis Katsoyannis.
Die erste Festphasensynthese von Peptiden auf festen Polymeren als Substrate wurde 1966 von Bruce Merrifield und Arnold Marglin mit der Merrifield-Synthese am Beispiel von Insulin durchgeführt. Dadurch stieg die Ausbeute pro Reaktionszyklus von 90 % auf 99,5 % und die Nebenreaktionsprodukte und Edukte konnten einfach durch Waschen entfernt werden, wodurch auch längere Peptide mit akzeptabler Ausbeute erzeugt werden konnten. 1984 erhielt er den Nobelpreis für Chemie für „seine Entwicklung der Methodik zur chemischen Synthese auf einer festen Matrix“.
Literatur
- W. C. Chan, P. D. White: Fmoc Solid Phase Peptide Synthesis. Reprint 2004, Oxford University Press, ISBN 0-19-963724-5.