
Pimavanserin
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Pimavanserin | |||||||||||||||
| Andere Namen |
|
|||||||||||||||
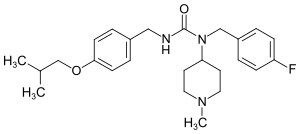
| Summenformel | C25H34F1N3O2 | |||||||||||||||
| Kurzbeschreibung |
weißer Feststoff (Tartrat) |
|||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| ATC-Code | ||||||||||||||||
| Wirkstoffklasse |
Antipsychotikum |
|||||||||||||||
| Wirkmechanismus |
inverser Agonist des Serotonin-5-HT2a-Rezeptors |
|||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 427,55 g·mol−1 1005,20 g·mol−1 als Tartrat |
|||||||||||||||
| Aggregatzustand |
fest |
|||||||||||||||
| Löslichkeit |
löslich in DMSO |
|||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Pimavanserin ist ein atypisches Antipsychotikum, das in den USA zur Behandlung von Psychosen bei der Parkinson-Krankheit zugelassen ist. Das Medikament wird als Pimavanserin-Tartrat unter dem Handelsnamen Nuplazid von der Firma Acadia Pharmaceuticals in den USA vertrieben. Pharmakologisch handelt es sich um einen inversen Serotonin-5-HT2a-Rezeptor-Agonist und -Antagonist.
In der EU und der Schweiz ist Pimavanserin bisher nicht zugelassen (Stand: 3. Oktober 2021).
Inhaltsverzeichnis
Pharmakologie
Pimavanserin ist der erste Vertreter einer neuen Wirkstoffklasse der Antipsychotika. Es bindet an den Serotonin-5-HT2a-Rezeptor mit hoher Affinität (Ki = 0,087 nM) und wirkt als Antagonist von Serotonin. Die Bindung ist 40-mal stärker als zum Serotonin-5-HT2c-Rezeptor. Die FDA verwendet die Bezeichnung „inverser Agonist“. Diese Einschätzung beruht ausschließlich auf tierexperimentellen Daten. Klinisch ergeben sich mehr Hinweise, dass Pimavanserin ein 5-HT2a-Rezeptor-Antagonist ist. Im Gegensatz zu anderen Antipsychotika hat es keine messbare Aktivität zu anderen serotonergen, dopaminergen, histaminergen, adrenergen oder muscarinergen Rezeptoren.
Nach Einnahme des Medikaments wird nach 6 Stunden der höchste Plasmaspiegel erreicht. Die mittlere Plasmahalbwertszeit beträgt 57 Stunden, die der aktiven Metaboliten 200 Stunden. Die Plasmabindung beträgt 95 %. Pimavanserin wird vornehmlich durch CYP3A4 und CYP3A5 metabolisiert, in geringerem Maße durch CYP2J2 und CYP2D6. Nur 0,5 % wird unverändert mit dem Urin ausgeschieden.
5-HT-Rezeptoren im Gehirn
Die Halluzinogene Mescalin, Psilocybin und Lysergsäuredimethylamid (LSD) sind 5-HT2a-Rezeptor-Agonisten. Die genetische oder pharmakologische Inaktivierung des 5-HT2a-Rezeptor-Signalweges verhindert die Verhaltensänderungen von Halluzinogenen bei Versuchstieren und Menschen. Daher erschien es aussichtsreich, zur Bekämpfung von Wahnvorstellungen und Halluzinationen einen 5-HT2a-Rezeptor-Antagonisten einzusetzen.
5-HT2a-Rezeptoren sind im Zentralnervensystem weit verbreitet und werden insbesondere im ventralen Striatum und ventralen Tegmentum exprimiert, die bei Psychosen involviert sind.
Entwicklung und Zulassung
Pimavanserin wurde von Acadia Pharmaceuticals als Antipsychotikum entwickelt, um Effektivität und das Nebenwirkungsprofil vorhandener Antipsychotika zu verbessern. Die Ergebnisse erster klinischer Erprobungen bezüglich der Effektivität der Toleranz und der Sicherheit einer zusätzlichen Behandlung mit Pimavanserin zu Risperidon und Haloperidol wurden im November 2012 publiziert. Die Auswertung zeigte, dass durch Pimavanserin der antipsychotische Effekt einer niedrig dosierten Risperidone-Behandlung verbessert wurde. Es verbesserte die Toleranz einer Behandlung mit Haloperidol, indem es die Häufigkeit eines extrapyramidalen Syndroms verminderte. Die Ergebnisse führten zur Planung einer Phase-III-Studie zur Behandlung von Psychosen bei Parkinsonsyndrom. Ferner wurde eine Phase 2 Studie initiiert, um die begleitende Verwendung von Pimavanserin im Rahmen einer antipsychotischen Behandlung der Schizophrenie zu prüfen. Am 2. September 2014 verlieh die amerikanische Zulassungsbehörde FDA dem Medikament den „Breakthrough Therapy Status“. Am 29. April 2016 erfolgte die FDA-Zulassung bei der Behandlung von Halluzinationen und Wahnvorstellungen im Zusammenhang mit einer Parkinson-Psychose. Am 29. Juni 2018 wurden von der FDA neue Dosierungen genehmigt. Eine 34 mg Kapsel und eine 10 mg Tablette wurden für die Behandlung von Halluzinationen und Wahnvorstellungen bei Parkinson-Erkrankten zugelassen. Diese ersetzen die 17 mg Tabletten. Die 10 mg Dosierung kommt bei Patienten zur Anwendung die CYP3A4-Inhibitoren, zum Beispiel Ketoconazol, einnehmen. In der EU und der Schweiz ist es bisher nicht zugelassen (Stand: 3. Oktober 2021).
Klinische Anwendung
Anwendungsgebiet und Art der Anwendung
Pimavanserin ist in den USA zur Behandlung von Psychosen, insbesondere Wahnvorstellungen und Halluzinationen, bei Patienten mit Parkinson-Erkrankung zugelassen. Die empfohlene Dosis beträgt 34 mg täglich. Die verminderte Dosis von 10 mg kommt bei Patienten zur Anwendung, die gleichzeitig CYP3A4-Inhibitoren einnehmen. Die gleichzeitige Einnahme mit CYP3A4-Induktoren (zum Beispiel Carbamazepin, Phenytoin, Rifampin) sollte vermieden werden. Zur Anwendung in der Schwangerschaft gibt es keine Daten. Im Tierversuch konnte bei schwangeren Ratten nichts krankhaftes festgestellt werden. Auch gibt es keine Daten über die Anwendung von Pimavanserin bei stillenden Müttern. Bei Einschränkung der Leberfunktion ist keine Anpassung der Dosis erforderlich. Auch bei Niereninsuffizienz und Dialyse kann die normale Dosis verwendet werden.
Klinische Studie
In einer randomisierten, doppelblinden, Placebo-kontrollierten Studie wurden Patienten mit Psychose beim Morbus Parkinson sechs Wochen behandelt. Die Wirkung wurde mit dem SAPS-PD (scale for assessment of positive symptoms, Parkinson's disease-adapted) bestimmt. Es ergab sich eine signifikante Verbesserung der Symptome Wahnvorstellungen und Halluzinationen.
Nebenwirkungen
Unter der Behandlung mit Pimavanserin kann es zu EKG-Veränderungen, einer Verlängerung des QT-Intervalls, kommen. Daher darf das Medikament nicht bei Patienten mit einer existierenden QT-Verlängerung oder einer Anamnese mit Arrhythmien verwendet werden. Ferner wurden Ganginstabilität und Fallneigung beobachtet. Verwirrung, Ödeme und Verstopfungen traten sowohl in der Behandlung als auch der Placebo-Gruppe auf. Die gleichzeitige Einnahme von CYP3A4-Inhibitoren, zum Beispiel Cimetidin, Erythromycin oder Ketoconazol, verstärkt die Wirkung. Bei diesen Patienten sollte eine reduzierte Dosis von 10 mg zur Anwendung kommen. Die Gesamtsterblichkeit ist bei der Behandlung von Psychosen dementer Patienten durch Antipsychotika, wie Pimavanserin, erhöht. Bei Alzheimer-Erkrankten mit Psychose wurden häufiger Aggressionen beobachtet.
Weitere Studien
Psychosen bei Alzheimer-Demenz
Die bisher bei Psychosen und Agitation dementer Patienten eingesetzten Antipsychotika der 2. Generation führen nach längerer Einnahme zu einer erhöhten Mortalität und vermehrten zerebrovaskulären Ereignissen. In einer randomisierten Phase-II-Studie prüften Ballard und Mitarbeiter die Wirkung von Pimavanserin bei Patienten mit Psychosen bei Alzheimer-Demenz. Zur Bestimmung der Wirksamkeit wurde der „NPI-NH Psychosis Score“ verwendet. Nach 6 Wochen Behandlung betrug dieser −3,76 mit Pimavanserin und −1,93 mit Placebo, also ein guter Effekt bei der Unterdrückung psychotischer Symptome. Nach 12 Wochen war kein Unterschied mehr messbar. Das Medikament ist für die Behandlung von Psychosen im Rahmen einer Alzheimer-Demenz gegenwärtig nicht zugelassen. Im Juni 2022 haben sich Experten des FDA-Beratungsausschusses mehrheitlich (9 zu 3 Stimmen) gegen die Empfehlung von Nuplazid zur Behandlung von Patienten mit Halluzinationen und Wahnvorstellungen im Zusammenhang mit der Alzheimer-Psychose (ADP) ausgesprochen.
Rückfallprävention bei demenzbedingter Psychose (HARMONY-Studie)
In einer randomisierten, doppelt verblindeten, Placebo-kontrollierten Phase-III-Studie wurde die Verwendung von Pimavanserin bei Patienten mit Psychose bei bestehender Demenz geprüft. Die Demenz hatte unterschiedliche Ursachen, in zwei Drittel der Fälle Alzheimer-Demenz, aber auch Lewy-Körper-Demenz, frontotemporale Demenz, Demenz bei Parkinson-Erkrankung oder vaskuläre Demenz. Die Studie wurde vorzeitig gestoppt, nachdem die Wirksamkeit nachgewiesen wurde. Nach 12 Wochen erlitten 13 % der Pimavanserin-Behandelten einen Rückfall der Psychose. Wurde kein Pimavanserin verabreicht, war bei 28 % der Erkrankten eine wiederauftretende Psychose zu beobachten (Hazard Ratio 0,35; 95 %-Konfidenzintervall = 0,17 bis 0,73, P = 0,005). Es wurden größere und länger andauernde Behandlungsstudien für notwendig gehalten. Die FDA lehnte einen Antrag auf Zulassung zur Behandlung von Halluzinationen und Wahnvorstellungen im Zusammenhang mit demenzbedingten Psychosen, der im Wesentlichen auf den Daten der HARMONY-Studie beruhte, im April 2021 ab.