Arylcyclohexylamine
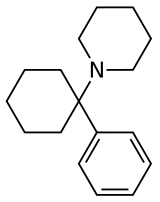
Arylcyclohexylamine, auch bekannt als Arylcyclohexamine oder Arylcyclohexanamine, sind eine chemische Klasse von (experimentellen) Arzneimitteln und Designerdrogen.
Inhaltsverzeichnis
Geschichte
Es wird angenommen, dass Phencyclidin (PCP) das erste entdeckte Arylcyclohexylamin mit anerkannten anästhetischen Eigenschaften ist. In der wissenschaftlichen Literatur wurden jedoch mehrere Arylcyclohexylamine vor PCP beschrieben, beginnend mit PCA (1-Phenylcyclohexan-1-amin), dessen Synthese erstmals 1907 veröffentlicht wurde. Eticyclidin (PCE) wurde 1953 und PCMo 1954 entdeckt, wobei die letztere Verbindung als starkes Beruhigungsmittel beschrieben wurde. Arylcyclohexylamin-Anästhetika wurden bei Parke-Davis intensiv untersucht, beginnend mit der Synthese von PCP und später der verwandten Verbindung Ketamin im Jahr 1956. In den 1970er Jahren wurden diese Verbindungen, insbesondere PCP und seine Analoga, aufgrund ihrer dissoziativen, halluzinogenen und euphorisierenden Wirkung als illegale Drogen konsumiert. Seitdem wurde die Stoffgruppe durch wissenschaftliche Forschung zu Stimulanzien, Analgetika und Neuroprotektiva sowie durch Chemiker auf der Suche nach neuartigen Freizeitdrogen erweitert.
Struktur
Ein Arylcyclohexylamin besteht aus einem Cyclohexylamin, das geminal zur Aminogruppe mit einer Arylgruppe substituiert ist. In den einfachsten Fällen ist die Aryleinheit ein Phenylring, gegebenenfalls mit zusätzlichen Substituenten.
Die Aminogruppe ist normalerweise nicht primär; die häufigsten N-Substituenten bei den sekundären Amine sind die Methyl- oder Ethylgruppe und bei den tertiären Aminen handelt es sich meist um Piperidin- und Pyrrolidinderivate.
Pharmakologie und Pharmakodynamik
Arylcyclohexylamine besitzen unterschiedlich NMDA-Rezeptor-antagonistische,Dopamin-Wiederaufnahmehemmende, und μ-Opioidrezeptor-agonistische Eigenschaften. Zusätzlich wirken sie am Sigma-Rezeptor agonistisch, an Nikotinrezeptoren antagonistisch, und an Dopamin D2-Rezeptoren agonistisch. Je nach Wirkstoff wurden unterschiedliche pharmakologische Wirkungen beobachtet. Der Antagonismus des NMDA-Rezeptors verleiht anästhetische, krampflösende, neuroprotektive und dissoziative Wirkungen; die Blockade des Dopamintransporters vermittelt stimulierende und euphorisierende Wirkungen sowie Psychosen in hohen Dosen; und die Aktivierung des μ-Opioidrezeptors verursacht analgetische und euphorisierende Wirkungen. Die Stimulation der σ- und D2-Rezeptoren kann auch zu halluzinogenen und psychotomimetischen Wirkungen beitragen.
Arylcyclohexylamine sind vielseitige Wirkstoffe mit einem breiten Spektrum möglicher pharmakologischer Wirkungen, je nach Umfang und Bereich, in dem Strukturchemische Modifikationen durchgeführt wurden. Die verschiedenen Modifikationsmöglichkeiten der chemischen Struktur ermöglichen eine "Feinabstimmung" des resultierenden pharmakologischen und pharmakodynamischen Profils. z. B. ist Benocyclidin (BTCP) ein selektiver Dopamin-Wiederaufnahmehemmer, PCP ist hauptsächlich ein NMDA-Antagonist, und Bromadol (BDPC) ist ein starker μ-Opioid-Agonist, während PRE-084 ein selektiver Sigma-Rezeptor-Agonist ist. Somit ist durch unterschiedliche Strukturkombinationen eine radikal unterschiedliche Pharmakologie und Pharmakodynamik möglich.
Liste der Arylcyclohexylamine
| Struktur | Verbindung | Arylgruppe | Amingruppe | Cyclohexylring |
|---|---|---|---|---|
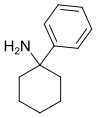
|
PCA | Phenyl | NH2 | - |

|
PCM | Phenyl | Methylamin | - |
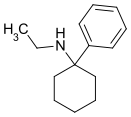
|
Eticyclidin | Phenyl | Ethylamin | - |
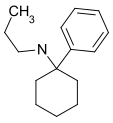
|
PCPr | Phenyl | n-Propylamin | - |

|
PCiP | Phenyl | Isopropylamin | - |

|
PCAL | Phenyl | Allylamin | - |

|
PCBu | Phenyl | n-Butylamin | - |

|
PCEOH | Phenyl | Hydroxyethylamin | - |

|
PCMEA | Phenyl | Methoxyethylamin | - |

|
PCEEA | Phenyl | Ethoxyethylamin | - |

|
PCMPA | Phenyl | Methoxypropylamin | - |

|
PCDM | Phenyl | Dimethylamin | - |

|
Dieticyclidin | Phenyl | Diethylamin | - |

|
2-HO-PCP | Phenyl | Piperidin | 2-Hydroxy |
|
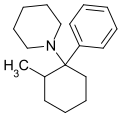
2-Me-PCP | Phenyl | Piperidin | 2-Methyl |

|
2-MeO-PCP | Phenyl | Piperidin | 2-Methoxy |

|
2-Keto-PCP | Phenyl | Piperidin | 2-Oxo |

|
Eticyclidon ("O-PCE") | Phenyl | Ethylamin | 2-Oxo |

|
2-Keto-PCPr | Phenyl | n-Propylamin | 2-Oxo |

|
4-Methyl-PCP | Phenyl | Piperidin | 4-Methyl |

|
4-Keto-PCP | Phenyl | Piperidin | 4-Oxo |

|
2'-Cl-PCP | o-Chlorophenyl | Piperidin | - |

|
2'-MeO-PCP | o-Methoxyphenyl | Piperidin | - |
|
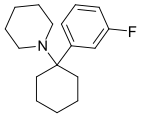
3'-F-PCP | m-Fluorophenyl | Piperidin | - |

|
3'-Me-PCP | m-Tolyl | Piperidin | - |

|
3'-Me-PCPy | m-Tolyl | Pyrrolidin | - |

|
3'-NH2-PCP | m-Aminophenyl | Piperidin | - |

|
3'-HO-PCP | m-Hydroxyphenyl | Piperidin | - |

|
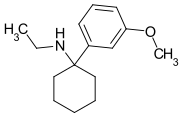
3'-MeO-PCP | m-Methoxyphenyl | Piperidin | - |
|
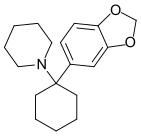
3',4'-MD-PCP | 3,4-Methylenedioxyphenyl | Piperidin | - |
|
3'-MeO-PCE | m-Methoxyphenyl | Ethylamin | - |

|
3'-HO-PCE | m-Hydroxyphenyl | Ethylamin | - |

|
3'-MeO-PCPr | m-Methoxyphenyl | n-Propylamin | - |
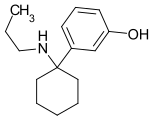
|
3'-HO-PCPr | m-Hydroxyphenyl | n-Propylamin | - |

|
3',4'-MD-PCPr | 3,4-Methylenedioxyphenyl | n-Propylamin | - |

|
3'-MeO-PCPy | m-Methoxyphenyl | Pyrrolidin | - |

|
4'-HO-PCP | p-Hydroxyphenyl | Piperidin | - |

|
Methoxydine (4'-MeO-PCP) | p-Methoxyphenyl | Piperidin | - |

|
4'-MeO-PCE | p-Methoxyphenyl | Ethylamin | - |

|
4'-F-PCP | p-Fluorophenyl | Piperidin | - |

|
4'-F-PCPy | p-Fluorophenyl | Pyrrolidin | - |
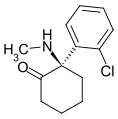
|
Arketamin | o-Chlorophenyl | Methylamin | 2-Oxo |

|
Deschloroketamin | Phenyl | Methylamin | 2-Oxo |

|
Esketamin | o-Chlorophenyl | Methylamin | 2-Oxo |

|
Ketamin | o-Chlorophenyl | Methylamin | 2-Oxo |

|
Hydroxynorketamin | o-Chlorophenyl | NH2 | 2-Oxo, 6-Hydroxy |

|
Ethketamin | o-Chlorophenyl | Ethylamin | 2-Oxo |

|
NPNK | o-Chlorophenyl | n-Propylamin | 2-Oxo |

|
Methoxyketamin | o-Methoxyphenyl | Methylamin | 2-Oxo |
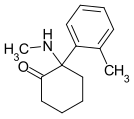
|
oMDCK | o-Tolyl | Methylamin | 2-Oxo |

|
mMDCK | m-Tolyl | Methylamin | 2-Oxo |

|
meta-Ketamin | m-Chlorophenyl | Methylamin | 2-Oxo |

|
iso-Ketamine | o-Chlorophenyl | Methylamin | 4-Oxo |

|
2-Fluorodeschloroketamin | o-Fluorophenyl | Methylamin | 2-Oxo |

|
3-Fluorodeschloroketamin | m-Fluorophenyl | Methylamin | 2-Oxo |

|
Bromoketamin | o-Bromophenyl | Methylamin | 2-Oxo |

|
TFMDCK | o-Trifluoromethylphenyl | Methylamin | 2-Oxo |
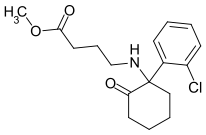
|
SN 35210 | o-Chlorophenyl | Carbomethoxybutylamin | 2-Oxo |
|
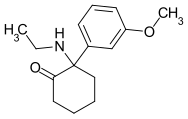
Methoxetamin (MXE) | m-Methoxyphenyl | Ethylamin | 2-Oxo |
|
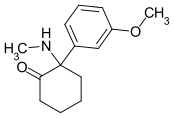
Methoxmetamin | m-Methoxyphenyl | Methylamin | 2-Oxo |
|
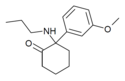
MXPr | m-Methoxyphenyl | n-Propylamin | 2-Oxo |
|
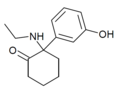
HXE | m-Hydroxyphenyl | Ethylamin | 2-Oxo |
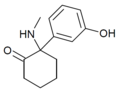
|
HXM | m-Hydroxyphenyl | Methylamin | 2-Oxo |
|
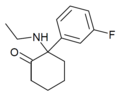
FXE | m-Fluorophenyl | Ethylamin | 2-Oxo |
|
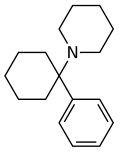
Phencyclidin (PCP) | Phenyl | Piperidin | - |
|
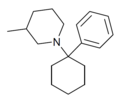
PC3MP | Phenyl | 3-Methylpiperidin | - |

|
PC4MP | Phenyl | 4-Methylpiperidin | - |

|
Rolicyclidin (PCPy) | Phenyl | Pyrrolidin | - |
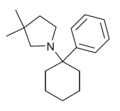
|
PCDMPy | Phenyl | 3,3-Dimethylpyrrolidin | - |
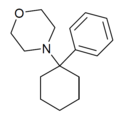
|
PCMo | Phenyl | Morpholin | - |

|
Methoxy-PCM (2'-MeO-PCMo) | o-Methoxyphenyl | Morpholin | - |

|
3'-MeO-PCMo | m-Methoxyphenyl | Morpholin | - |

|
4'-MeO-PCMo | p-Methoxyphenyl | Morpholin | - |

|
Methyl-PCM (4'-Me-PCMo) | p-Tolyl | Morpholin | - |

|
Hydroxy-methyl-PCM | 2-Methyl-4-hydroxyphenyl | Morpholin | - |
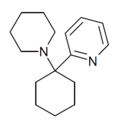
|
PYCP | 2-Pyridinyl | Piperidin | - |
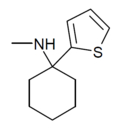
|
TCM | 2-Thienyl | Methylamin | - |
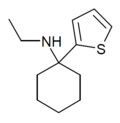
|
TCE | 2-Thienyl | Ethylamin | - |
|
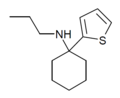
TCPr | 2-Thienyl | Propylamin | - |

|
Tenocyclidin (TCP) | 2-Thienyl | Piperidin | - |
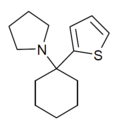
|
TCPy | 2-Thienyl | Pyrrolidin | - |

|
Tiletamin | 2-Thienyl | Ethylamin | 2-Oxo |

|
Gacyclidin | 2-Thienyl | Piperidin | 2-Methyl |
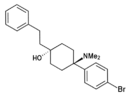
|
BDPC | p-Bromophenyl | Dimethylamin | 4-Phenethyl-4-hydroxy |

|
C-8813 | p-Bromophenyl | Dimethylamin | 4-(thiophen-2-yl)ethyl-4-hydroxy |

|
Dimetamin | p-Tolyl | Dimethylamin | 4-Oxo |

|
3''-OH-2'-Me-PCP | o-Tolyl | 3-Hydroxypiperidin | - |

|
4''-Ph-4''-OH-PCP | Phenyl | 4-Phenyl-4-hydroxypiperidin | - |
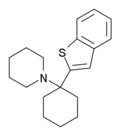
|
BTCP | Benzothiophen-2-yl | Piperidin | - |

|
BTCPy | Benzothiophen-2-yl | Pyrrolidin | - |
Analoge Verbindungen
Die Strukturabhängigkeit der halluzinogenen Wirkung von Phencyclidin wurde durch Variation der Cycloalkanringgröße untersucht. Es zeigt sich, dass die entsprechende Cyclopentylverbindung etwa 1/10 der halluzinogenen Wirksamkeit aufweist, während die Cycloheptyl- und Cyclooctylderivate inaktiv sind. Die homologen Verbindungen erhält man durch Umsetzung der jeweiligen Cycloalkylketonen mit Phenylmagnesiumbromid. Der resultierende Alkohol wird anschließend mit Natriumazid umgesetzt und dann mit Lithiumaluminiumhydrid zum Amin reduziert. Im letzten Schritt wird dann der Piperidinring mit 1-5-Dibrompentan aufgebaut.
Weblinks
- H Morris, J Wallach: From PCP to MXE: a comprehensive review of the non-medical use of dissociative drugs. In: Drug Test Anal. 6. Jahrgang, Nr. 7–8, 2014, S. 614–32, doi:10.1002/dta.1620, PMID 24678061.
- Synthesis and Effects of PCP Analogs
- Interview with a Ketamine Chemist

