Barbitursäure
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Barbitursäure | ||||||||||||||||||
| Andere Namen |
|
||||||||||||||||||
| Summenformel | C4H4N2O3 | ||||||||||||||||||
| Kurzbeschreibung |
farbloses, kristallines Pulver mit schwachem Geruch |
||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 128,09 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest |
||||||||||||||||||
| Schmelzpunkt |
250–252 °C (Zersetzung) |
||||||||||||||||||
| pKS-Wert |
4,01 (25 °C) |
||||||||||||||||||
| Löslichkeit |
mäßig in Wasser (11,45 g·l−1 bei 20 °C) |
||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−634,7 kJ/mol |
||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Barbitursäure ist eine heterocyclische chemische Verbindung, die als Ausgangssubstanz zur Herstellung der Barbiturate und in der Analytik Verwendung findet. Die Substanz zählt zu den Derivaten des Harnstoffs, zu den Lactamen, ist ein cyclisches Ureid und gleichzeitig ein hydrierter Abkömmling des Pyrimidins.
Inhaltsverzeichnis
Geschichte
Die Konstitution der Barbitursäure wurde erstmals 1864 von Adolf von Baeyer bei seinen Studien über Harnsäure erkannt. Er soll seine Entdeckung nach seiner Geliebten Barbara benannt haben. Nach anderen Quellen bekam die Barbitursäure zu Ehren der Alchemistin Barbara von Cilli (1390–1451) ihren Namen.
Baeyer fand heraus, dass die Verbindung zu Harnstoff und Malonsäure hydrolysiert werden kann. Die Synthese aus diesen Abbauprodukten wurde 1879 von dem französischen Chemiker Grimaux realisiert, der diese mit Phosphoroxychlorid als wasserentziehendem Mittel reagieren ließ.
Nach der Synthese der Diethylbarbitursäure im Jahr 1902 und deren Anwendung als Veronal verbreitete sich die Verwendung der Barbitursäure, deren Eigenschaften man durch chemische Abwandlung zu verbessern versuchte.
Darstellung und Gewinnung
Barbitursäure kann aus Harnstoff und einem Malonsäureester, z. B. Malonsäurediethylester, in wasserfreiem Ethanol mit darin gelöstem Natriumethanolat hergestellt werden:
Eigenschaften
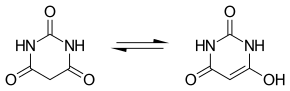
Für die Barbitursäure kann ein Tautomeriegleichgewicht mit einer Keto- und einer Enolform formuliert werden. In der Gasphase und in Lösung liegt das Gleichgewicht auf der Seite der Ketoform, die unter diesen Bedingungen die stabile Form darstellt.
In fester Phase existieren vier polymorphe Anhydratformen sowie zwei polymorphe Dihydratformen. Die Kristallgitter der Anhydratformen I, II und III enthalten das Ketotautomer. Das Polymorph IV besteht aus Molekülen des Enoltautomers, welches wegen der stabilisierenden Wirkung von Wasserstoffbrücken das thermodynamisch stabile Polymorph darstellt. Es zeigt bei 172 °C eine endotherme Festphasenumwandlung zum Polymorph II. Beide Polymorphe stehen enantiotrop zueinander. Das Polymorph II wandelt sich bei 240 °C enantiotrop in das Hochtemperaturpolymorph III um, welches dann bei 253 °C schmilzt. Das Dihydrat bildet unterhalb von −56 °C eine monokline Tieftemperaturform. Oberhalb dieser Temperatur existiert eine orthorhombische Hochtemperaturform. Oberhalb von 30 °C dehydratisiert diese Form zur Anhydratform II.
Wie der Name sagt, reagiert die Verbindung sauer. Ihr pKs-Wert beträgt 4,01. Daher wurde früher diskutiert, ob die Formel der Barbitursäure nicht als 2,4,6-Trihydroxypyrimidin geschrieben werden sollte. Dies ist eine tautomere Form des cyclischen Harnstoff-Derivates.
Später wurde erkannt, dass die Imid-Form selbst als Säure fungieren kann: Ihr Anion (Barbiturat) ist durch Delokalisierung der negativen Ladung stabilisiert.
Verwendung
Barbitursäure ist selbst nicht sedativ-hypnotisch wirksam. Erst Derivate mit geeigneten Substituenten besitzen eine hypnotische Wirkung (siehe Barbiturate). Als erstes derartiges Barbiturat wurde 1903 Diethylbarbitursäure (Barbital) von Emil Fischer und Joseph von Mering beschrieben.
In der Trink- und Abwasseranalytik wird Barbitursäure als Reagenz zur kolorimetrischen Cyanidanalyse (CN−-Ion) verwendet.
Literatur
- J. R. Partington: A History of Chemistry. Band 4, 1964, OCLC 270846068, S. 777.
- Hans Beyer, Wolfgang Walter: Lehrbuch der Organischen Chemie. 21. Auflage. Hirzel, Stuttgart 1988, ISBN 3-7776-0438-0, S. 784.