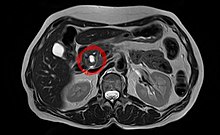
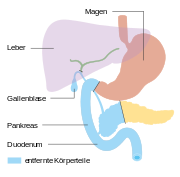
Bauchspeicheldrüsenkrebs
| Klassifikation nach ICD-10 | |
|---|---|
| C25.- | Bösartige Neubildung des Pankreas |
| C25.0 | Pankreaskopf |
| C25.1 | Pankreaskörper |
| C25.2 | Pankreasschwanz |
| C25.3 | Ductus pancreaticus |
| C25.4 | Endokriner Drüsenanteil des Pankreas, Inkl.: Langerhans-Inseln |
| C25.7 | Sonstige Teile des Pankreas, Inkl.: Pankreashals |
| C25.8 | Pankreas, mehrere Teilbereiche überlappend |
| C25.9 | Pankreas, nicht näher bezeichnet |
| ICD-10 online (WHO-Version 2019) | |
Bauchspeicheldrüsenkrebs, fachsprachlich auch Pankreaskarzinom, ist ein bösartiger (maligner) Tumor der Bauchspeicheldrüse (altgriechisch πάγκρεας pánkreas). Die Mehrheit der Pankreastumoren (genannt auch Pankreasgeschwülste) befällt den die Verdauungsenzyme bildenden Teil der Bauchspeicheldrüse und hier vorwiegend die Gänge innerhalb des Organs. Diese „duktalen Adenokarzinome“ gehören zu den häufigen Krebserkrankungen. Die wichtigsten Risikofaktoren sind Bauchspeicheldrüsenentzündungen, Alkoholabusus sowie Tabakrauchen und einige Erbkrankheiten. Häufigste Symptome sind eine stetig zunehmende Gelbsucht, in den Rücken ausstrahlende und nachts an Stärke zunehmende Bauchschmerzen sowie Verdauungsstörungen und Gewichtsverlust.
Pankreaskarzinome wachsen aggressiv und bilden früh Tochtergeschwülste (Metastasen). Sie können bisher nur durch operative Entfernung behandelt werden, allerdings werden vier von fünf bösartigen Pankreastumoren erst in einem so weit fortgeschrittenen Stadium erkannt, dass keine Heilung mehr möglich ist. Chemo- und Strahlentherapie haben in der Behandlung von Bauchspeicheldrüsenkrebs eine unterstützende Funktion. Bei der Operation wird die Bauchspeicheldrüse teilweise oder vollständig entfernt (Pankreatektomie) und die unterbrochenen Gallen- und Bauchspeicheldrüsenausgänge werden wieder mit dem Darmtrakt verbunden. Die Heilungsrate ist in den letzten Jahrzehnten besser geworden; gleichwohl nehmen Palliation (Linderung) und bestmöglich unterstützende Behandlungsmaßnahmen (Best Supportive Care) in den Pankreaszentren immer noch breiten Raum ein.
In neuerer Zeit richtet sich die Aufmerksamkeit der Onkologen zunehmend auf zystische Neubildungen des Pankreas, die gutartig oder bösartig sein können.
Inhaltsverzeichnis
- 1 Geschichte
- 2 Anatomie
- 3 Häufigkeit und Ursachen
- 4 Histopathologie
- 5 Symptome
- 6 Diagnostik
- 7 Stadieneinteilung
- 8 Behandlung
- 9 Prognose
- 10 Tierexperiment
- 11 Literatur
- 12 Weblinks
- 13 Einzelnachweise
Geschichte
Der griechische Arzt Rufus von Ephesos soll die Bauchspeicheldrüse erstmals als Organ beschrieben haben. Galenos bemerkte, dass sie ein Sekret absondert, hielt das Organ aber für ein Polster des Magens – eine Vorstellung, die sich bis Mitte des 17. Jahrhunderts hielt. Mit Auszehrung (Phthisis) verbundene Erkrankungen beschrieb 1812 Christian Friedrich Harleß. Die Verdauungsfunktion des Sekrets wurde erst Mitte des 19. Jahrhunderts von Claude Bernard endgültig bewiesen.
Die ersten Versuche einer histologischen Einteilung von Pankreastumoren erfolgten in den 1880er Jahren.
Operationen der Bauchspeicheldrüse, vor allem mit Entfernung (Resektion) größerer Anteile der Drüse, galten lange als unmöglich. Erst gegen Ende des 19. Jahrhunderts gelangen einzelne derartige Eingriffe, und bis 1898 waren erst neun Entfernungen veröffentlicht worden. Bekannt ist eine erfolgreiche Linksresektion (s. u.) durch Friedrich Trendelenburg 1882. 1890 entdeckten Oskar Minkowski und Josef von Mering, dass die Entfernung der Bauchspeicheldrüse die Zuckerkrankheit verursacht, und damit entdeckten sie indirekt das Insulin, welches dann 1921 von Frederick Banting und Charles Best erstmals isoliert wurde. Im Jahr 1940 standardisierte Allen Oldfather Whipple die von Walther Kausch und vermutlich auch etwa gleichzeitig von Alessandro Codivilla entwickelte Operationstechnik, bei der Bauchspeicheldrüse und Zwölffingerdarm gemeinsam entfernt werden. Diese Vorgehensweise zählt bis heute zu den gebräuchlichen Standardverfahren. Das schwierigste Problem der Resektionen bestand stets darin, den Abfluss des Bauchspeicheldrüsensekrets in den Darm sicherzustellen. Ab etwa 1950 erarbeiteten Chirurgen dafür verbesserte Methoden und Instrumente, beginnend mit der Idee von Charles Frey, den Rest der Bauchspeicheldrüse mit einer eröffneten Darmschlinge zu vernähen.
Grundlage der Entwicklung von chirurgischen Therapien war die Einführung der Röntgendiagnostik gewesen, insbesondere die der selektiven Angiographie.
Todesfälle von Prominenten wie die des Schauspielers Patrick Swayze im Herbst 2009 oder des Tenorsängers Luciano Pavarotti im Februar 2007 sowie das jahrelange Ringen des Apple-Gründers Steve Jobs mit dieser Krankheit – er litt unter einer seltenen, aber gut behandelbaren Unterform (neuroendokriner Pankreastumor) und verstarb im Oktober 2011 – trugen dazu bei, den Bauchspeicheldrüsenkrebs einer breiteren Öffentlichkeit bekannter zu machen.
Anatomie
Die Bauchspeicheldrüse ist eine 40 bis 120 g schwere Drüse im Retroperitoneum, hinter dem Magen, links vom Zwölffingerdarm und wird in einen Kopf, einen Körper und einen Schwanz untergliedert. Der Schwanz berührt links Milz und Niere. Der Hauptgallengang durchquert rechts den Kopf der Bauchspeicheldrüse. Die Aorta und mehrere große Eingeweidearterien (Truncus coeliacus, obere Mesenterialarterie, Milzarterie) haben engen Kontakt zur Bauchspeicheldrüse, ebenso die untere Hohlvene und die Pfortader. Alle diese Strukturen können von Bauchspeicheldrüsenkrebs erfasst werden. Die Ausführungsgänge für das Bauchspeicheldrüsensekret (Wirsung- und der beim Menschen nur selten vorkommende Santorini-Gang) verlaufen durch das ganze Organ und können vom Tumor verstopft werden. Ihre Blutversorgung erhält die Bauchspeicheldrüse aus dem Truncus coeliacus und der oberen Mesenterialarterie, manchmal auch aus einer abweichenden Leberarterie, was Operationen erheblich erschweren kann. Das verbrauchte Blut fließt in die obere Mesenterialvene und in die Milzvene ab. Die Lymphe strömt in alle Richtungen zu den nächstgelegenen Lymphknotengruppen (Bauchspeicheldrüsen-, obere und untere Bauchspeicheldrüsen-Zwölffingerdarm-, Leber-, Zölikial-, obere Mesenterial-, Milzlymphknoten und obere paraaortale Lymphknoten), die alle von einer Metastasierung betroffen sein können.
Die Bauchspeicheldrüse ist überwiegend exokrin („nach außen ausscheidend“): Ihr Verdauungssekret wird über die beiden Ausführungsgänge in den Zwölffingerdarm abgegeben. Sie enthält aber auch endokrine („nach innen ausscheidende“) Zellgruppen in den sogenannten Langerhans-Inseln, die die Hormone (unter anderen Insulin und Glucagon) produzieren und an das Blut abgeben. Beide Gewebe können prinzipiell Tumoren entwickeln. Über 95 % der Pankreastumoren entstehen aus dem exokrinen Organ, genauer gesagt aus dem Gangepithel und den Azinuszellen. Neben den meist gutartigen serös-zystischen Neoplasien (SCN, früher „seröse Zystadenome“) sind es vor allem Karzinome. Tumoren des endokrinen Pankreasgewebes kommen dagegen fast nur bei erblichen Syndromen vor. Sie werden zu den neuroendokrinen Tumoren gerechnet.
Drei Viertel der Tumoren entstehen im Pankreaskopf, dem am weitesten rechts, am Zwölffingerdarm gelegenen Anteil. 20 % der Tumoren treten im mittleren Anteil (Corpus) und fünf Prozent im linksseitigen Pankreasschwanz auf.
Häufigkeit und Ursachen
Das Pankreaskarzinom, der mit Abstand häufigste Pankreastumor, verursacht in Deutschland etwa 14.000 Neuerkrankungen jährlich – die Neuerkrankungsrate liegt bei rund 18 pro 100.000 Einwohner und Jahr. In der deutschen Krebsstatistik steht es bei Männern an der zehnten, bei Frauen an der neunten Stelle (Stand: 2006). Bei den Krebstodesfällen belegt es den vierten Platz. Die Erkrankten sind meist älter als 60 Jahre. Männer sind häufiger betroffen als Frauen (1,6:1). In der Schweiz erkrankten von 2010 bis 2014 durchschnittlich 1292 Menschen pro Jahr (51,5 % Frauen; 48,5 % Männer) und starben 1177 Menschen pro Jahr. Seit einigen Jahren werden in Expertengremien Signale für eine zunehmende Inzidenz diskutiert, es liegen jedoch häufig nur fragmentierte epidemiologische Daten und Auswertungen vor. Unter Zugrundelegung der Datenbank “Surveillance, Epidemiology, and End Results” (SEER), die 37 % der US-Bevölkerung erfasst, wurde nun die Veränderung der Inzidenz seit Beginn des Jahrtausends als durchschnittliche jährliche prozentuale Veränderung beschrieben. Hierbei wurden zwischen 2000 und 2018 insgesamt 283.817 Pankreaskarzinome erfasst. Es zeigt sich sowohl bei Frauen als auch bei Männern ein Anstieg der Inzidenz. Auffällig war, dass besonders bei jüngeren Frauen (<55 Jahre) die Erkrankungshäufigkeit anstieg. Trotz erwartungsgemäß sehr niedriger Gesamtinzidenz ist diese Zunahme bei 15–34-Jährigen besonders ausgeprägt.
Wichtigster Risikofaktor neben dem Lebensalter ist die chronische Pankreatitis (Bauchspeicheldrüsenentzündung): Etwa einer von 50 davon Betroffenen entwickelt innerhalb von zehn Jahren ein Karzinom. Diabetes verdoppelt das Karzinomrisiko aus bislang unbekanntem Grund. Lebensstilbezogene Gefahren sind Zigarettenrauchen (Raucherentwöhnung reduziert das Risiko nach zwei Jahren auf die Hälfte), Vitamin-D-Mangel, starkes Übergewicht (BMI > 30) und fettreiche Ernährung. Angeborene Risiken sind Syndrome mit allgemein gesteigerter Krebserkrankungsrate wie das Peutz-Jeghers-Syndrom, die erbliche Pankreatitis und die zystische Fibrose. Zwei oder mehr Pankreaskarzinomfälle in der nahen Verwandtschaft erhöhen das Risiko um ein Vielfaches. Screeninguntersuchungen werden gegenwärtig nur für Familien mit erblicher Pankreatitis oder mehreren Pankreaskarzinomfällen empfohlen; üblich ist dann eine jährliche Endosonografie ab dem 50. Lebensjahr. Ungefähr 5 % der Patienten weisen eine ererbte Mutation in einem der beiden Gene BRCA1 oder BRCA2 auf. Diese Mutation bringt ein erhöhtes Risiko mit sich, an bestimmten Krebsarten zu erkranken (bei Frauen am häufigsten Brustkrebs, aber auch Bauchspeicheldrüsenkrebs). Falls diese Krebsformen in der Familie auffällig häufig aufgetreten sind, sollte der an Bauchspeicheldrüsenkrebs erkrankte Patient auch darauf genetisch getestet werden, weil sich hier unter Umständen die Möglichkeit einer gezielteren Behandlung ergibt (s. u.).
Chemische Karzinogene (Naphthylamin, Benzidin oder Nitrosamine) können das Erkrankungsrisiko erhöhen. Auch chlororganische Verbindungen und polycyclische aromatische Kohlenwasserstoffe werden verdächtigt.
Für die Karzinome sind ein aggressives Wachstum, eine schnelle Metastasierung und ein schlechtes Ansprechen auf die verfügbaren Behandlungen kennzeichnend. Das liegt auch an dem besonders hohen Entartungsgrad: Wachstumsregulierende oder tumorunterdrückende Gene wie jene für HER2/neu, KRAS, p16, p53 und DPC4 sind in den Tumorzellen sehr häufig durch Mutationen inaktiviert.
Histopathologie
Pankreastumorzellen können Ähnlichkeit mit Zellen der Gänge (duktal), der Azini und Langerhans-Inseln aufweisen, aber auch gemischten Charakter haben. In der Regel richten sich die Pathologen nach der WHO-Klassifikation bösartiger Tumoren, derzeit in der Ausgabe von 2019. Die meisten bösartigen Tumoren (Malignome) werden danach als Varianten des duktalen Adenokarzinoms bezeichnet, eingestuft von hochdifferenziert bis undifferenziert.
Die wichtigsten Vorstufen des duktalen Adenokarzinoms sind einmal die intraepitheliale Neoplasie des Pankreas (PanIN), zum anderen die intraduktale papillär-muzinöse Neoplasie (IPMN), eine Form der zystischen Pankreasneoplasien.
Azinuszellkarzinome, endokrine Langerhanszell-Karzinome, nichtepitheliale Malignome (Lymphome und Sarkome) sind selten, ebenso die Pankreasmetastasen von anderen Organtumoren.
Der häufigste gutartige Tumor des Pankreas ist die serös-zystische Neoplasie.
Adenokarzinom
Adenokarzinome des Gangsystems können sich direkt bilden oder aus sogenannten Präkanzerosen entwickeln. Dies sind oberflächliche Wucherungen des Epithels, wobei vor allem papilläre Hyperplasien – nach neuer Nomenklatur pankreatische epitheliale Neoplasien 3 (PanIN 3) – als gefährlich gelten. Nach dem Grad der Entdifferenzierung vergibt der Pathologe das Grading G1 bis G4.
Zunächst gutartige Tumoren wie die muzinös-zystische Neoplasie und die intraduktale papillär-muzinöse Neoplasie zeigen ein hohes Entartungsrisiko.
Bei den Adenokarzinomen kann man im Mikroskop je nach ihrem Entartungsgrad noch schleimgefüllte Drüsenschläuche mit Zylinderepithel erkennen („duktaler Typ“). Die Nervenscheiden sind fast immer tumorinfiltriert. Charakteristisch ist außerdem eine Verdichtung des umgebenden Bindegewebes („desmoplastische Reaktion“), die in den bildgebenden Verfahren schlecht vom eigentlichen Tumor zu unterscheiden ist. „In der aktuellen WHO-Klassifikation werden die seltenen, prognostisch relevanten Subtypen wie das hochmaligne adenosquamöse Karzinom oder das niedrigmaligne Kolloidkarzinom [(muzinöse nichtzystische Karzinom, mikroskopisch „Schleimseen“)] deutlich untereinander und vom duktalen Adenokarzinom [...] abgegrenzt“.
Karzinome sind bei Diagnosestellung meist 2 bis 5 cm groß (bildgebend nachweisbar ab etwa 1 cm Größe). Sie sind unscharf begrenzt, von fester Konsistenz und grau-gelblicher Farbe, oft zentral nekrotisch. Es kommt häufig zu einer Verengung (Stenose) der durch die Bauchspeicheldrüse verlaufenden Strecke des Gallengangs, häufig auch zu einer Stenose des Pankreas-Ausführungsgangs. Der Tumor kann in die Wand des Zwölffingerdarmes einwachsen, weiterhin auch wichtige Gefäßstrukturen wie die obere Mesenterialarterie, die Milzvene, die Pfortader und/oder die untere Hohlvene infiltrieren. Die Feststellung dieser Beteiligungen ist für die Stadienbestimmung (Staging) und damit für das weitere therapeutische Vorgehen von großer Bedeutung.
Die meisten duktalen Adenokarzinome exprimieren die Mucine 1 (= CA 15-3), 3, 5/6, und 16 (= CA 125) sowie das Glykoprotein CA 19-9 auf den Zellmembranen.
Die ersten Metastasen finden sich in den benachbarten Lymphknoten und – über den Blutstrom der Pfortader – in der Leber. Tumoren im Pankreaskörper und Pankreasschwanz sind bei Diagnosestellung zumeist größer als Pankreaskopftumoren und haben meistens schon zu Lebermetastasen oder einer Infiltration des Bauchfells (Peritonealkarzinose) geführt.
Zystische Pankreasneoplasien (PCN)
Zystische Pankreas-Neoplasien („Neubildungen“) werden nach verschiedenen Schätzungen in 2–45 % der Allgemeinbevölkerung gefunden. Einzelne sind gutartig, andere sind Präkanzerosen oder Anfangsstadien invasiver Karzinome, wobei die Differenzierung oft schwierig ist. Die 2018 veröffentlichten evidenzbasierten europäischen Richtlinien schlagen optimale diagnostische und therapeutische Handlungsstrategien vor.
Es werden meist vier Haupttypen unterschieden:
- Intraduktale papillär-muzinöse Neoplasie (IPMN). Mit 25 % die häufigste Form.
- Muzinös-zystische Neoplasie (MCN),
- Serös-zystische Neoplasie (SCN),
- Solide pseudopapilläre Neoplasie (SPN).
Daneben gibt es noch andere seltenere Formen zystischer Neoplasien sowie einige zystische Varianten anderer Pankreastumoren.
Intraduktale papillär-muzinöse Neoplasie (IPMN)
Die IPMN ist eine Unterart der zystischen Pankreasneoplasien. „Histologisch sind IPMN durch eine intraduktale Proliferation eines neoplastischen Gangepithels mit Schleimproduktion charakterisiert.“ Man nimmt an, dass viele dieser primär gutartigen muzinösen Neoplasien irgendwann zuerst niedriggradige, später höhergradige Dysplasien entwickeln und schließlich in ein invasives intraduktales papillär-muzinöses Karzinom übergehen. Anzeichen einer möglicherweise beginnenden malignen Entartung können sog. besorgniserregende Charakteristika (engl. „worrisome features“) sein (s. u. „Diagnostik“):
- Erhöhte Serumkonzentration von CA 19-9 (>37 U/ml)
- Durchmesser des Pankreashauptgangs 5–9,9 mm
- Zystendurchmesser über 30 mm
- Kontrastmittelaufnehmende intramurale Knoten bis 5 mm Durchmesser
- Neoplasieinduzierte akute Pankreatitis
- Verdickte bzw. kontrastmittelaufnehmende Zystenwände
- Wachstumsrate der Zysten >5 mm in 2 Jahren
- Kalibersprünge des Pankreasganghauptgangs mit distaler Pankreasatrophie
- Lymphadenopathie.
Bei Vorliegen von Hochrisikofaktoren (Gelbsucht, kontrastierte Wandknoten >5 mm, Pankreashauptgang >10 mm) ist eine maligne Transformation mit Ausbreitung des Tumors im Gangsystem des Pankreas, beginnend meist im Kopfteil, zu befürchten.
Man unterscheidet einen Hauptgangtyp (schlechtere Prognose), einen Seitenasttyp und einen kombinierten Typ. Das normale Gangepithel wird durch hochzylindrische neoplastische Zellen in kleinknotig-warzenförmigen (papillären) Wucherungen ersetzt, die zähflüssigen Schleim (Muzin) bilden, der nur schwer abfließt und den Gangabschnitt unregelmäßig bis auf drei oder vier Zentimeter erweitert. Die Tumorzellen können die gesamte Bauchspeicheldrüse erfassen. Bei etwa 30 % der Patienten bestehen zum Zeitpunkt der Diagnosestellung schon Gefäßeinbrüche durch das invasive Wachstum.
Muzinös-zystische Neoplasie (MCN)
Die muzinös-zystische Neoplasie wird auch muzinös-zystischer Tumor, muzinöses Zystadenom oder Zystadenokarzinom genannt. Dieser Tumor kann gut- oder bösartig sein. Computertomographie- oder Magnetresonanztomographie-Bilder können diese nicht unterscheiden, deshalb werden gut- und bösartige Varianten unter diesem Begriff zusammengefasst und unabhängig von den Symptomen immer operiert. 40- bis 60-jährige Frauen sind bevorzugt betroffen. Die 2 bis 12 cm großen Tumoren weisen eine breite Bindegewebskapsel auf. Sie bestehen meist aus weniger als sechs großen Zysten, die mit muzinproduzierendem Zylinderepithel ausgekleidet sind. Gelingt die operative Entfernung, ist die Prognose dieses Tumors gut; selbst die bösartige Variante erreicht Fünf-Jahres-Überlebensraten um 75 %.
Serös-zystische Neoplasie (SCN)
Die serös-zystische Neoplasie, auch als seröses Zystadenom oder als mikrozystisches (Zyst-)Adenom bezeichnet, ist ein meist gutartiger Tumor (Malignitätsrisiko <5 %), der vorwiegend bei Frauen im höheren Lebensalter beobachtet wird. Er liegt häufiger im Pankreaskopf, jedoch kann jede Region betroffen sein. Zystadenome können 6 bis 10 cm groß werden. Sie bestehen im Unterschied zum muzinös-zystischen Tumor (s. o.) aus kleinen Zysten mit serösem Inhalt, die durch zarte Septen getrennt sind. Im Zentrum findet man eine narbenartige Verdichtung und oft auch Verkalkungen. Diese Zysten sind mit kubischem Epithel ausgekleidet, histologisch finden sich keine Atypien oder Mitosefiguren. Eine Assoziation mit dem Von-Hippel-Lindau-Syndrom wurde beschrieben, der Tumor kann dabei große Abschnitte der Bauchspeicheldrüse einnehmen. Das seröse Zystadenom weist keine Entartungstendenz auf und sollte nur entfernt werden, wenn es durch seine Größe Symptome verursacht.
Solide pseudopapilläre Neoplasie (SPN)
Sie ist selten, meist sind junge Frauen betroffen. Histologisch handelt es sich um Pseudozysten, keine zystischen Gebilde. Die Malignität liegt bei 10 %.
Tumoren der Papilla Vateri
Die Tumoren im Bereich der gemeinsamen Mündung des Gallen- und Pankreasgangs (Papilla Vateri) sind meist Adenokarzinome; sie sollen manchmal aus tubulovillösen Adenomen hervorgehen. Die Prognose des Papillenkarzinoms ist relativ gut, da die rasch auftretende Gelbsucht zu einer frühzeitigen Erkennung führt. Ausbreitung und Metastasierung verlaufen wie beim Adenokarzinom.
Azinuszellkarzinom
Dieser seltene Tumor der Azinuszellen kommt doppelt so häufig bei Männern wie bei Frauen vor (Altersgipfel: 55–65 Jahre). Obwohl die Tumoren gewöhnlich relativ groß sind (4–6 cm), werden sie oft erst entdeckt, wenn sie bereits in die Leber metastasiert sind. Gelegentlich kommt es, durch eine massive Sekretion von Lipasen bedingt, zu Fettgewebsnekrosen unter der Haut sowie zu Gelenkschmerzen.
Endokrine Tumoren
Endokrine Pankreastumoren (Synonym pankreatische neuroendokrine Neoplasien PaNEN, veraltet: Karzinoide) entstehen aus den endokrinen Drüsenzellen der Bauchspeicheldrüse und bilden nur etwa 1–2 % der Pankreastumoren. Höchstens 50 % sind funktionell, d. h. sie bilden vermehrt Hormone und verursachen dadurch Krankheitserscheinungen. Dazu zählen:
- Insulinom
- Gastrinom (Zollinger-Ellison-Syndrom)
- Somatostatinom
- Glucagonom
- VIPom (Verner-Morrison-Syndrom)
Ein gehäuftes Auftreten findet man beim Syndrom der multiplen endokrinen Neoplasie (MEN1-Syndrom). Davon abgesehen gibt es neuroendokrine Pankreastumoren im Kindesalter praktisch gar nicht; später treten sie in allen Altersklassen sowie bei Männern und Frauen etwa gleich selten auf. Die Prävalenz liegt unter 1/100.000.
Endokrine Tumoren sind begrenzte, einzeln auftretende, runde Tumoren mit einem Durchmesser von 1 bis 4 cm und können in allen Teilen des Pankreas auftreten. Histologisch handelt es sich um einheitlich aussehende Tumorzellen mit einem feinkörnigen Zytoplasma. Die Zellen sind solide, trabekulär und pseudoglandulär angeordnet. Immunhistologisch sind endokrine Tumoren positiv für die Marker NSE, Synaptophysin und Chromogranin A (CgA), letzterer ist auch im Blutserum bei vielen Erkrankten erhöht. Im Elektronenmikroskop sieht man in den Tumorzellen neurosekretorische Hormongranula.
Nach der WHO-Klassifikation von 2010 sind alle PaNEN potentiell bösartig. Die histologisch gut differenzierten Tumoren (neuroendokrine Tumoren NET) werden nach dem Ki67/MIB1-Index in hoch- und mitteldifferenziert (< 2 % = G1, 2–20 % = G2) unterteilt. Die hochproliferierenden (Ki67-Index > 20 %) sogenannten neuroendokrinen Karzinome NEC werden als G3 eingestuft und nochmals in klein- und großzellige Subtypen unterteilt.
Kriterien zur prognostischen Einschätzung von neuroendokrinen Pankreastumoren (WHO 2010) sind neben diesem Differenzierungsgrad und der TNM-Klassifikation noch das Vorliegen von mikroskopischen Gefäßeinbrüchen und die hormonelle Aktivität:
| Metastasierungsrisiko | Histologie | Differenzierung | TNM |
|---|---|---|---|
| minimal (benignes Verhalten) | NET, keine Angioinvasion | G1 | T1 N0 M0 |
| gering | NET | G2 | T1-2 N0 M0 |
| erheblich | NET | G1-2 | T2>4 cm oder T3, N0-1, M0-1 |
| hochmalignes Verhalten | NEC | G3, funktionell inaktiv | jedes T, N, M |
Insulinproduzierende Tumoren sind in über 90 % der Fälle gutartig, dagegen sind Gastrinome, Glukagonome, VIPome und ACTH-produzierende sowie die nichtfunktionellen PanNEN meistens bösartig. Sie wachsen und metastasieren vergleichsweise langsam, sodass auch Patienten mit Metastasen noch eine mittlere Überlebensdauer von über vier Jahren erreichen.
Symptome

Unspezifische Symptome wie Missempfindungen/Druck im Oberbauch, Appetitlosigkeit, Übelkeit, Verdauungsprobleme und depressive Verstimmungen können erste Anzeichen des Pankreaskopfkarzinoms sein. Später zeigt sich häufig das Leitsymptom des Pankreaskopfkarzinoms, eine zunehmende, nicht von Koliken begleitete Gelbsucht (Ikterus), die durch die Verengung des Gallengangs verursacht wird. Diese Gelbsucht ist nur bei Papillentumoren ein Frühsymptom, ansonsten Zeichen eines fortgeschrittenen Befundes. In den Rücken ausstrahlende Bauchschmerzen (u. a. gürtelförmig ausstrahlende Schmerzen im mittleren Rückenbereich) sind ebenfalls häufig, aber uncharakteristisch. Allerdings sind die quälenden, über Monate langsam zunehmenden dumpfen, nachts verschlimmerten Schmerzen, die durch Infiltration des Sonnengeflechtes entstehen, oft der erste Anlass, einen Arzt aufzusuchen. Ein Courvoisier-Zeichen (prall tastbare Gallenblase) ist möglich. Verengungen des Pankreasgangs beeinträchtigen die Drüsenfunktion und verursachen Verdauungsbeschwerden, Gewichtsverlust um mehr als 10 % und Diabetes (u. a. plötzlich auftretend). Weitere Anzeichen können Durchfall und Fettstühle (lehmartig, hell) sein. Thrombosen (u. a. Beinvenenthrombose) und neue Pigmentierungen der Haut sind Warnhinweise auf einen Tumor im Bauchraum. Im späten Erkrankungsstadium können Metastasen zur Lebervergrößerung, Leberfunktionsstörung, Bauchwassersucht und hochgradiger Abmagerung führen.
Diagnostik
Laboruntersuchungen
Serum, Blut
- Das Carbohydrat-Antigen CA 19-9 ist der etablierteste Tumor-Biomarker für das duktale Pankreas-Karzinom mit einer Sensitivität von 70–95 %. Obwohl der Wert auch bei anderen gastrointestinalen Karzinomen und (meist nur vorübergehend) bei gutartigen Erkrankungen erhöht sein kann, beträgt seine diagnostische Spezifität noch 72–90 %. CA 19-9 wird häufig sowohl zur Diagnose als auch zur Prognose des Pankreas-Adenokarzinoms verwandt und dient außerdem zur diagnostischen Unterscheidung der malignen (Spezifität 88 %, Sensitivität 40 %) und der invasiven (Spezifität 89 %, Sensitivität 52 %) IPMN von der gutartigen Form für einen Grenzwert von 37 U/ml.
- Das Carcinoembryonale Antigen CEA hat nach einer Metaanalyse zwar eine hohe Spezifität von 93–95 %, seine niedrige Sensitivität von 18 % schließt es als Screening-Parameter jedoch aus.
- Das C-reaktive Protein CRP selbst ist ein Entzündungsparameter. In einer retrospektiven Studie wurde seine Konzentration mit der des Serumalbumins ins Verhältnis gesetzt. Der Quotient CAR war bei Erhöhung >0,083 bei 83 später operierten Patienten ein unabhängiger statistischer Parameter zur Prognose der malignen Transformation einer IPMN (Sensitivität 52 %, Spezifität 93 %).
- Der Quotient der Konzentrationen von neutrophilen Granulozyten und Lymphozyten (jeweils Anzahl pro Volumeneinheit), NLR, ist ein Entzündungsparameter, der bei IPMN-Trägern mit einem Grenzwert von 2,074 ein invasives von einem nichtinvasiven Karzinom mit einer Sensitivität von 73 % und einer Spezifität von 58 % unterscheiden konnte. In einer retrospektiven Studie an 272 IPMN-Patienten war ein NLR>4 ein unabhängiger Vorhersagewert für ein später als invasiv erkanntes Karzinom. Demnach ist ein höherer NLR-Wert Hinweis auf eine maligne Entartung, besonders, wenn er mit anderen Parametern kombiniert wird. Über den genauen Schwellenwert wird noch diskutiert.
- Der Quotient der Konzentrationen von Thrombozyten und Lymphozyten, PLR, ist ebenfalls ein Entzündungsparameter. Er war bei einem Wert von PLR>208 ein unabhängiger Vorhersagewert für die Malignität einer muzinproduzierenden zystischen Pankreasneoplasie. Bei den nach den Fukuoka-Richtlinien als Risikopatienten eingestuften Personen war ein hoher PLR-Wert zu 83 % (gegenüber 42 % ohne weiteres Risiko) mit einem invasiven Karzinom verbunden. Andere Autoren fanden jedoch keine Korrelation des PLR-Wertes mit dem Risiko.
Zystenflüssigkeit
Anlässlich einer Endosonografie kann durch eine ultraschallgesteuerte Feinnadelpunktion einzelner Zysten Material zur Analyse gewonnen werden.
- CEA im Punktat: Ein CEA-Wert >192 ng/ml konnte mit einer diagnostischen Genauigkeit von 88 % muzinöse (MCN, IPMN) von nichtmuzinösen Zysten/Pseudozysten (SCN, SPN) unterscheiden. Sehr kleine Werte (<5 ng/ml) sprachen mit eine Spezifität von 95 % für eine serösen Zyste, sehr große Werte (>800 ng/ml) mit einer Spezifität von 98 % für eine muzinöse Zyste. Die CEA-Werte im Punktat können eine Dysplasie oder ein invasives Karzinom nicht erkennen.
- Glukose im Punktat: Aufgrund der verschiedenen Stoffwechselaktivität der die Zystenwand bildenden Zellverbände unterscheiden sich die Glukosekonzentrationen muzinöser (kleinerer Wert) von der seröser (größerer Wert) Zysten. Bei einem Schwellenwert von 50 mg/dl konnten mit einer Sensitivität von 92 % und einer Spezifität von 87 % beide Zystenarten identifiziert werden.
- Amylase im Punktat: Pseudozysten (SPN) haben eine deutlich niedrigere Amylaseaktivität (<250 U/l) als wahre Zysten. Mit diesem Schwellenwert können zwar Pseudozysten mit einer Sensitivität von 44 % und einer Spezifität von 98 % ausgeschlossen werden, eine weitere Differenzierung ist jedoch nicht möglich.
- Muzin im Punktat: Muzin kann durch spezielle Färbungen oder unter Verwendung genetischer Methoden nachgewiesen werden. Von den verschiedenen Muzintypen wird Mucin-1 (= CA 15-3) vom normalen Pankreasgewebe nicht exprimiert. Bei Werten über 30 U/ml muss eine maligne Entartung angenommen werden, bei kleineren Werten kann eine gutartige Veränderung vorliegen. MUC4 wurde in zunehmendem Maße mit fortschreitender Entartung einer IPMN gefunden.
- Zytologie: Die Papanicolaou Society of Cytopathology unterscheidet bei der pankreatobiliären Zytologie in einem Stufenschema 6 verschiedene diagnostische Kategorien. Eine bestehende maligne Entartung bei muzinösen Zysten wird mit einer Spezifität von 83–99 %, aber einer Sensitivität von nur 25–88 % erkannt. Bei positivem Nachweis ergibt sich eine absolute Operationsindikation.
Stuhltests
Noch immer wird ein verlässlicher Screening-Test zur Frühdiagnose des Pankreaskarzinoms gesucht. Andererseits wurden Zusammenhänge zwischen Karzinomentstehung und Darmmikrobiom vielfach vermutet. Um die Frage zu klären, ob es ein für Pankreaskarzinomträger spezifisches Darmmikrobiom gibt, wurden Stuhlproben von 57 Erwachsenen mit duktalem Pankreaskarzinom (davon 25 im Frühstadium) verglichen mit denen von 50 Gesunden und denen von 27 Patienten mit chronischer Pankreatitis. Die Zusammensetzung der Mikrobiome wurde durch RNA-Analysen ermittelt. „Eine Software identifizierte auf der Basis des maschinellen Lernens eine für die Krebspatienten charakteristische genetische Signatur der Darmflora, die auf der unterschiedlichen Konzentration von 27 Mikroorganismen beruhte.“
Im Ergebnis hatten „Krebspatienten [...] häufiger
- Methanobrevibacter smithii
- Fusobacterium nucleatum
- Alloscardovia omnicolens
- Veillonella atypica
- Bacteroides finegoldii
im den Stuhlproben, während die Konzentration von
- Faecalibacterium prausnitzii
- Bacteroides coprocola
- Bifidobacterium bifidum
- Romboutsia timonensis
geringer war als in den Vergleichsgruppen.“
In der ROC-Kurve, die Sensitivität und Spezifität gemeinsam bewertet, erreichte der Test einen zu geringen AUC-Wert für einen Screeningtest. Wenn allerdings der Stuhltest durch eine Bestimmung des Tumormarkers CA 19-9 im Serum erweitert wurde, erhöhte sich der Wert auf 0,94. Für den Test sprach außerdem, dass die Ergebnisse in einer 2. Gruppe von 76 Person, darunter 44 mit duktalem Pankreaskarzinom, bestätigt werden konnten. Bei Erhöhung der Spezifität fiel der AUC-Wert zwar leicht auf 0,83 ab, er konnte aber bei 5.792 untersuchten Stuhlproben von anderen Patienten, die unter Krankheiten wie Diabetes mellitus, Darmkrebs, Lebererkrankungen, Morbus Crohn, Colitis ulcerosa litten, bis auf wenige falsch-positive fast alle richtig zuordnen. Ob sich jedoch der Test zur Frühdiagnose eignet, müsste durch weitere Studien gezeigt werden.
Neue Perspektiven
Bessere diagnostische Parameter werden noch gesucht; die Forschung konzentriert sich gegenwärtig auf Proteomik (Eiweißprofile), microRNAs und auf KRAS-Mu tationen in Serum und Gallenflüssigkeit, wobei letzterer Parameter in Vorstudien über 90 % Sensitivität und Spezifität erreichte. Beim Adenokarzinom der Bauchspeicheldrüse (PDAC) kann durch die Untersuchung von DNA-basierten Biomarkern in exosomaler Speichel-DNA (exoDNA) mittels Liquid Biopsy die Früherkennung, Tumorstratifizierung, Therapiestratifizierung und das Monitoring bei Patienten mit PDAC durchgeführt werden.
Bildgebende Verfahren
Sonografie, Computertomographie und Kernspintomographie sind die Diagnoseverfahren der Wahl. Aufgabe dieser Methoden ist, Krebserkrankungen von gutartigen Tumoren zu unterscheiden. Weiterhin ist zu erkennen, ob ein Tumor operabel ist. Dies entscheidet sich daran, ob Metastasen vorliegen und ob die dem Pankreas anliegenden Arterien (Arteria mesenterica superior, Truncus coeliacus, Arteria hepatica) von dem Tumor betroffen sind. Die Darstellung der Blutgefäße wird dabei in der Regel durch Gabe von Kontrastmitteln verbessert.
Die ERCP (eine Kombination aus Endoskopie und Röntgenkontrastdarstellung) kann den Verschluss des Gallen- oder Pankreasganges nachweisen und bei günstiger Lage eine Biopsie des Tumors ermöglichen.
Die zu ihr in Konkurrenz stehende MRCP bietet zwar nicht die Möglichkeit einer Biopsie, ist aber praktisch risikolos, weil sie nichtinvasiv ist und keine Gabe eines Kontrastmittels erfordert.
Die Endosonografie ermöglicht durch einen mit dem Endoskop verbundenen Ultraschallkopf durch die Magen- bzw. Duodenalwand hindurch eine genauere Beurteilung des Tumors sowie der Pankreaszysten und möglicher Metastasen in der Umgebung. Eine Punktion einzelner Zysten dient dabei der risikoarmen Materialgewinnung zur Analyse. Auch der Tumor selbst kann im fortgeschrittenen Stadium einer Biopsie zugänglich sein.
Spezialkliniken halten gelegentlich auch die neu entwickelte Pankreatikoskopie vor, eine Endoskopie bis in das Pankreasgangsystem hinein, die noch in der Erprobung steht und die auf das Gangsystem beschränkte Neubildungen möglicherweise am besten darstellen kann.
Wenn die genannten Diagnosemethoden nicht ausreichen, um eine schwere chronische Pankreatitis sicher von einem Tumor unterscheiden zu können, oder um eine Peritonealkarzinose nachzuweisen, bleibt zuletzt noch die Bauchspiegelung (Diagnostische Laparoskopie). Dieser Eingriff wird heute meist mit einer laparoskopischen Ultraschallsonde und einer Bauchspülung kombiniert, was als „erweiterte diagnostische Laparoskopie“ (EDL) bezeichnet wird.
Stadieneinteilung
Die klinischen und apparativen Untersuchungen liefern die Tumordiagnose und das Tumorstadium (Grad der Ausbreitung). Die TNM-Klassifikation dient zur international einheitlichen Klassifikation der Ausbreitung bösartiger Tumoren. Beim Pankreaskarzinom wird sie wie folgt vorgenommen:
| T | Primärtumor |
|---|---|
| TX | Primärtumor kann nicht beurteilt werden. |
| T0 | kein Primärtumor nachweisbar |
| Tis | Carcinoma in situ (= frühestes, noch nicht invasives Tumorstadium) |
| T1 | größter Durchmesser des Primärtumors ≤ 2 cm |
| T1a | größter Durchmesser des Primärtumors ≤ 0,5 cm |
| T1b | größter Durchmesser des Primärtumors > 0,5 cm und ≤ 1 cm |
| T1c | größter Durchmesser des Primärtumors > 1 cm und ≤ 2 cm |
| T2 | größter Durchmesser des Primärtumors > 2 cm und ≤ 4 cm |
| T3 | größter Durchmesser des Primärtumors > 4 cm |
| T4 | Angrenzende große Arterien sind infiltriert (Truncus coeliacus, A. mesenterica superior und/oder Arteria hepatica communis). |
| N | regionäre Lymphknoten |
| NX | Die regionären Lymphknoten können nicht beurteilt werden. |
| N0 | keine regionären Lymphknotenmetastasen |
| N1 | Metastasen in 1 – 3 regionären Lymphknoten |
| N2 | Metastasen in > 3 regionären Lymphknoten |
| M | Fernmetastasen |
| MX | Fernmetastasen können nicht beurteilt werden. |
| M0 | keine Fernmetastasen |
| M1 | Fernmetastasen |
Aus der Ausbreitung ergibt sich das Tumorstadium, nach dem sich die Behandlung richten wird.
| Stadium | |
|---|---|
| IA | T1 N0 M0 (Tumor bis 2 cm, keine Metastasen) |
| IB | T2 N0 M0 (Tumor innerhalb des Pankreas, keine Metastasen) |
| IIA | T3 N0 M0 (Tumor noch operabel, keine Metastasen) |
| IIB | T1-3 N1 M0 (Tumor noch operabel, mit regionären Lymphknotenmetastasen) |
| III | T1-4 N2 M0 (lokal fortgeschritten, ohne Fernmetastasen) |
| IV | T1-4 N0-2 M1 (Fernmetastasen) |
Anmerkungen: Diese Klassifikation gilt nur für Karzinome des exokrinen Pankreas. Eine gesonderte Klassifikation gilt für Tumoren der Ampulla Vateri und für gut differenzierte neuroendokrine Tumoren des Pankreas
Die Stadien T1 bis T3 gelten auch, wenn eine Invasion des peripankreatischen Weichgewebes vorliegt.
Regionäre Lymphknoten von Pankreaskopfkarzinomen liegen
- am Ductus choledochus
- an der Arteria hepatica communis
- an der Vena portae, ferner
- pylorische Lymphknoten
- subpylorische Lymphknoten
- proximale mesenteriale Lymphknoten
- zöliakale Lymphknoten
- posteriore und anteriore pankreaticoduodenale Lymphknoten
- Lymphknoten entlang der Vena mesenterica superior
- Lymphknoten rechts der A. mesenterica superior
Regionäre Lymphknoten von Pankreaskarzinomen des Körpers und des Schwanzes liegen
- an der Arteria hepatica communis
- an der Milzarterie und am Milzhilus
- zöliakale Lymphknoten
- laterale aortale Lymphknoten
Jeglicher Befall nicht regionärer Lymphknoten erfordert die Klassifikation M1.
Behandlung
Gestaute Gallenwege können zunächst mit einem endoskopisch platzierten Stent (Röhrchen) freigemacht werden, um den Allgemeinzustand des Patienten zu verbessern. Es gibt auch Verfahren, bei denen die Galle aus der Leber durch einen Katheter nach außen abgeleitet wird. Ist beides unmöglich, kann ein begrenzter chirurgischer Eingriff Entlastung verschaffen. Bei operablen Tumoren wird wegen der Gefahr von aufsteigenden Infektionen und Wundheilungsstörungen in der Regel auf die vorherige Entlastung verzichtet, mit Ausnahme von schwersten Stauungen (z. B. Bilirubin-Spiegel > 10 mg/dl). Weitere Erstmaßnahmen richten sich gegen die oft (25 %) bestehende Mangelernährung, die das Operationsrisiko deutlich erhöht, gegen Eiweiß- und Vitaminmangel (insbesondere fettlösliche Vitamine) und gegen diabetische Stoffwechselstörungen.
Um die Versorgung zu verbessern und aktuellen Erkenntnissen gerecht zu werden, hat die Deutsche Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselerkrankungen (DGVS) im Dezember 2021 eine aktualisierte S3-Leitlinie „Exokrines Pankreaskarzinom“ herausgegeben.
Operative Behandlung
Die ersten Operationen mit Entfernung von Bauchspeicheldrüsengewebe bei Vorliegen von Bauchspeicheldrüsentumoren erfolgten zwischen 1881 und 1913. Zu den Pionieren der Pankreasresektionen gehörten unter anderem Friedrich Trendelenburg, F. Franke, Rudolf Krönlein und Walther Kausch. Etwa vier von fünf Pankreaskarzinomen sind, wenn sie erkannt werden, schon zu weit fortgeschritten und können nicht mehr mit dem Ziel der Heilung (kurativ) operiert werden. Auch wenn nur einzelne Lebermetastasen vorliegen, kann man – im Unterschied zum Darmkrebs – mit deren Entfernung keine Heilung erreichen. Tumoren, die weder große Arterien infiltriert noch Fernmetastasen verursacht haben (UICC-Stadien I und II), können prinzipiell noch komplett entfernt werden. Infiltrierte Venen machen den Eingriff nicht unmöglich; befallene Lymphknoten werden mit entfernt. Ob auch nicht befallene Lymphknoten sicherheitshalber entfernt werden sollten, ist umstritten.
Es ist sinnvoll, möglichst einen Teil des Organs zu erhalten und wieder mit dem Darm zu verbinden. Je nach Ort des Tumors wird deshalb die rechtsseitige Teilresektion (Duodenopankreatektomie, mehrere Varianten), eine mittlere Teilresektion, eine linksseitige Teilresektion (Pankreasschwanzresektion, meist mit Entfernung der Milz) oder eine Totalresektion (vollständige Entfernung) der Bauchspeicheldrüse durchgeführt, meist einschließlich aller regionären Lymphknoten. Der Magen und der Gallengang müssen wieder mit dem Darm verbunden werden. Man verwendet dafür entweder eine oder mehrere hochgezogene Dünndarmschlingen, die spannungsfrei angeschlossen werden. Bei der Verwendung mehrerer Dünndarmschlingen werden diese rekonstruiert nach der klassischen von César Roux erdachten Methode. Nach Teilresektion kann der Ausführungsgang des belassenen Rests der Bauchspeicheldrüse sowohl mit dem Dünndarm als auch mit dem Magen verbunden werden.
Alle genannten Eingriffe sind schwerwiegend und aufwändig. Frühe Komplikationen wie Pankreatitis, Sepsis, Anastomoseninsuffizienz (Lecks in den Darmnähten), Wundheilungsstörungen und Fisteln (abnorme Gangsysteme) sind sehr häufig. Werden Lymphgänge erheblich verletzt, kann ein Chylaskos (Lymphaustritt in die Bauchhöhle) die Folge sein. Die bedrohlichste Komplikation ist die Nachblutung aus großen Blutgefäßen, die vor allem bei mehrfachen perioperativen Manipulationen (ERCP) oder bei Entzündungen im Operationsgebiet droht. Diabetes bekommen etwa zehn Prozent der Patienten nach Teilresektionen und ausnahmslos alle nach Totalresektionen des Pankreas. Bei einer exokrinen Pankreasinsuffizienz als häufige Folge des operativen Eingriffs müssen körpereigene Verdauungsenzyme des Pankreas in der Regel lebenslang in Kapsel- oder Tablettenform (Pankreatin, Rizoenzyme) ersetzt werden.
- Operationsvarianten
Pylorus-erhaltende Teilresektion
Duodenopankreatektomie nach Whipple
Die Enukleation (Ausschälung) ist eine sehr gewebesparende Technik, bei der nur der Tumor entfernt wird. Sie ist für gutartige Befunde und oberflächlich gelegene neuroendokrine Tumoren geeignet. Der Tumor muss Abstand vom Gangsystem haben.
Mit einer Segmentresektion werden definierte Teile der Bauchspeicheldrüse entfernt: entweder der Kopf einschließlich Zwölffingerdarm, der mittlere (zentrale) Abschnitt oder der linksseitige Teil. Die Milz kann mit entfernt oder bei geeigneten Fällen belassen werden. Vom Ausführungsgang abgeschnittenes Gewebe muss entweder in eine nach Roux Y-förmig (d. h. end-zu-seit-) angenähte Dünndarmschlinge oder in den Magen drainiert werden.
Die den pyloruserhaltende Duodenopankreatektomie nach den kalifornischen Chirurgen Longmire und Traverso erhält im Gegensatz zu der Kausch-Whipple-Operation den gesamten Magen bis zum Pförtnermuskel (Pylorus).
Die subtotale oder totale Pankreasentfernung bringt als Maximaleingriff die höchste Letalität mit sich. In etwa 6 % der Operationen kommt sie zum Einsatz. Gefürchtete Komplikation ist der schwer einstellbare Brittle-Diabetes.
Inwieweit die benachbarten Lymphknoten vorbeugend ebenfalls zu entfernen sind, ist noch nicht abschließend geklärt. Jeder zweite Patient hat bei der Krankenhausaufnahme schon Lymphknotenmetastasen entwickelt. Die Standard-Lymphonodektomie umfasst die um die Bauchspeicheldrüse und am Zwölffingerdarm liegenden Lymphknoten sowie jene rechts der oberen Gekrösearterie und teilweise der aus dem Leber-Zwölffingerdarm-Band. Das radikale Konzept skelettiert komplett den Truncus coeliacus, das Leber-Zwölffingerdarm-Band und die Aorta auf Höhe der Bauchspeicheldrüse. Ein noch weitergehendes japanisches Vorgehen schließt sämtliche Lymphknoten an der Bauchaorta vom Zwerchfell bis zur Endaufzweigung ein. Bisher ist eine Erhöhung der Heilungsrate dieser Varianten nicht nachgewiesen.
Palliativoperationen dienen zur Symptomlinderung. Beispielsweise wird mit der Choledochojejunostomie eine Verbindung zwischen dem gestauten Gallengang und dem Darm geschaffen, um die Galle aus der Leber abzuleiten. Bei einem drohenden Verschluss des Zwölffingerdarmes kann das Herstellen einer Verbindung zwischen Magen und Darm (Gastrojejunostomie) sinnvoll sein.
Chemotherapie
Eine vor der Operation durchgeführte („neoadjuvante“) Chemotherapie kann nach der gegenwärtigen Phase-II-Studienlage einige fortgeschrittene Tumoren so weit verkleinern, dass sie operabel werden, die Daten sind aber noch zu schwach für eine allgemeine Empfehlung. Nur wenn die Standardchemotherapie nicht mehr wirkt, nutzt man als second line eine Kombination aus Oxaliplatin, 5-Fluoruracil (5-FU) und Folinsäure (OFF-Schema). Als Erstlinientherapie gegen neuroendokrine Tumoren empfiehlt die ENETS in Abhängigkeit von der Wachstumstendenz die Gabe von Somatostatinrezeptoranaloga oder Everolimus. Des Weiteren verwendet man eine Kombinationschemotherapie von Streptozocin mit Doxorubicin oder 5-FU, bei hochgradig bösartigen neuroendokrinen Tumoren Cisplatin und Etoposid. Alternativ werden Temozolomid und Capecitabin erprobt.
Dagegen ist eine nach der Operation durchgeführte (adjuvante) Chemotherapie anerkannter Standard, weil die Rezidivrate (s. u.) extrem hoch ist. Jede Woche 1× 1000 mg/(m² KOF) Gemcitabin drei Wochen lang, dann eine Woche Pause, dann der nächste Zyklus, ist das in Europa gebräuchlichste Schema. In den USA wird eher 5-Fluoruracil eingesetzt. Kombinationen mehrerer Zytostatika verbessern die Wirkung bei Karzinomen bisher nicht, sind allerdings der Standard bei NET.
| Chemotherapie | Therapienutzen/medianes Überleben |
|---|---|
| Gemcitabin- Monotherapie 3-wöchentlich |
Gesamtüberleben bei 5,9 Monaten |
| Gemcitabin +Erlotinib |
Erlotinib brachte nur bei den Patienten, die einen Hautausschlag entwickelten, einen Nutzen; Gesamtüberleben bei diesen Patienten 10,5 Monaten |
| FOLFIRINOX | nur bei Patienten mit ECOG 0 bis 1, Alter < 75 Jahre, normalem Bilirubin, nebenwirkungsreich! Gesamtüberleben 11,1 Monate |
| Gemcitabin +nab-Paclitaxel |
Gesamtüberleben im Vergleich zur Gemcitabin-Monotherapie von 6,6 auf 8,7 Monate verlängert |
| nal-Irinotecan +5FU/FA |
Zugelassen für Patienten nach Gemcitabin-haltiger Therapie; Gesamtüberleben im Vergleich zur 5FU/FA-Monotherapie mit 6,1 versus 4,2 Monate signifikant besser |
| Olaparib-Erhaltungstherapie | Bei metastasierten Patienten, die eine BRCA1/2-Mutation aufweisen und die zuvor eine platin-haltige Therapie erhalten haben, unter der sie nicht progredient waren (progressionsfreies, aber nicht Gesamtüberleben verbessert). Bisher (08/2019) nicht zugelassen! |
Unheilbare (d. h. primär inoperable oder metastasierte) Tumoren können mit einer Chemotherapie palliativ behandelt werden, z. B. mit Gemcitabin. Ein anderer Ansatz ist es, das Zytostatikum über einen von der Leistenarterie eingebrachten Katheter in eine tumorversorgende Arterie zu spritzen, z. B. in die Arteria pancreatica magna (lokoregionäre Chemotherapie). Damit kann die Dosis am Tumor ohne zusätzliche Nebenwirkungen gesteigert werden. Es gibt aber bisher nur Phase-I-Studien (kleine Fallserien) zu dieser teuren und technisch sehr aufwändigen Methode.
Wie bei vielen anderen Krebserkrankungen setzt die Medizin auch beim Pankreaskarzinom zunehmend auf die Gezielte Krebstherapie (targeted therapy), d. h. auf monoklonale Antikörper, andere Biologika und small molecules. Außerhalb von Studien ist der Tyrosinkinase-Inhibitor Erlotinib gegen Pankreaskarzinome zugelassen; außerdem der Tyrosinkinase-Inhibitor Sunitinib und der mTOR-Inhibitor Everolimus gegen endokrine Tumoren.
Erlotinib wird in der Regel in Kombination mit Gemcitabin (3-wöchentlich) gegeben. Hier zeigte sich in einer Therapiestudie, dass die Hinzunahme von Erlotinib zu Gemcitabin zu einer geringen, aber statistisch signifikanten Verlängerung des medianen Gesamtüberlebens führte (6,24 versus 5,91 Monate). Allerdings war dieser Vorteil nur auf die Subgruppe von Patienten beschränkt, die während der Therapie einen deutlichen Hautausschlag entwickelten. Diese Patientengruppe hatte ein medianes Gesamtüberleben von 10,5 Monaten. Es wird daher empfohlen, die Behandlung mit Erlotinib nur dann fortzuführen, wenn nach spätestens acht Wochen ein Hautausschlag aufgetreten ist.
Bei metastasierten oder primär inoperablen Patienten, die in einem sehr guten Allgemeinzustand (ECOG-Score 0-1) sind, können auch intensivere Therapien durchgeführt werden. Ein solches Therapieregime ist FOLFIRINOX (5-Fluorouracil, Leukovorin, Oxaliplatin, Irinotecan). Mit FOLFIRINOX zeigte sich bei diesen Patienten ein signifikant besseres Gesamtüberleben als mit Gemcitabin-Monotherapie (11,1 versus 6,8 Monate). Dieser Vorteil muss allerdings auch mit deutlich höheren Nebenwirkungen erkauft werden. Ähnlich ist es bei der Kombination Gemcitabin/nab-Paclitaxel (Albumin-Nanopartikel-gebundenem Paclitaxel), die in einer Phase III-Studie das mediane Gesamtüberleben von metastasierten Patienten auf 8,7 Monate verbesserte. Paclitaxel ist in Deutschland in Kombination mit Gemcitabin für die Therapie des Adenokarzinoms des Pankreas zugelassen.
Im Februar 2016 wurden in der Fachzeitschrift The Lancet die Ergebnisse einer dreiarmigen internationalen Phase III-Studie veröffentlicht. In dieser sogenannten NAPOLI-1-Studie wurden Patienten mit metastasiertem Pankreaskarzinom behandelt, die zuvor eine Gemcitabin-haltige Therapie erhalten hatten. Ein Studienarm bestand aus einer Behandlung mit 5-Fluorouracil und Folinsäure (5FU/FA), ein zweiter aus einer Behandlung mit nanoliposomalem Irinotecan („nal-Irinotecan“, „nalIRI“) und ein dritter, später hinzugenommener Studienarm enthielt eine Kombination aller drei Medikamente. Das mediane Überleben der Patienten im dritten Studienarm war mit 6,1 Monaten signifikant besser als das der Patienten im ersten Studienarm (5FU/FA, 4,2 Monate). Die nalIRI-Monotherapie war dagegen nicht signifikant besser als die 5FU/FA-Therapie. Als Konsequenz dieser Studie wurde die Kombinationsbehandlung nalIRI+5FU/FA für Patienten mit metastasiertem Pankreaskarzinom und vorheriger Gemcitabin-haltiger Therapie im Oktober 2016 zugelassen.
Gegen die durch hormonproduzierende (funktionell aktive) Tumoren verursachten Symptome können Somastostatinanaloga wie Octreotid und Interferon-alpha eingesetzt werden, die Krankheit wird damit jedoch nicht aufgehalten.
Eine im Juli 2019 publizierte Studie fand, dass sich das krankheitsfreie Überleben (nicht aber das Gesamtüberleben) bei Patienten mit metastasiertem Bauchspeicheldrüsenkrebs, die eine BRCA1- oder BRCA2-Mutation aufwiesen und zuvor eine platin-haltige Therapie (z. B. FOLFIRINOX) erhalten hatten, deutlich verbessern ließ, wenn diese anschließend eine Erhaltungstherapie aus Olaparib (2 × 300 mg täglich) erhielten. Es wurden nur Patienten in die Studie eingeschlossen, die unter der vorangegangenen platinhaltigen Therapie keine Krankheitsprogression gezeigt hatten.
Radiotherapie
Die Radiotherapie (Strahlentherapie) spielt bei der Behandlung der Pankreasmalignome insgesamt eine geringe Rolle und wird fast nur noch in modifizierter (u. a. Peptid-Rezeptor-Radionuklidtherapie (PRRT)),) oder kombinierter (Radiochemotherapie (auch neoadjuvant), neoadjuvante Partikeltherapie, intraoperative Radiotherapie, stereotaktische ablative Radiotherapie u. a.) angewandt, speziell bei Versagen der Erstlinientherapie.
Radiochemotherapien erhöhen nachweislich die örtliche Tumorkontrolle, allerdings wird dabei weder Metastasierung noch Sterblichkeit verringert, sodass darauf meist verzichtet wird. Lediglich zur Schmerzlinderung kann eine vorsichtig dosierte Radiochemotherapie beitragen.
Experimentelle Therapieansätze
Forscher der LMU München verfolgen Ansätze, die Immuntherapie weiter zu treiben. Konkret geht es darum, dass Abwehrzellen das Tumorgebiet erreichen und es schaffen, zu den eigentlichen Krebszellen vorzudringen. Die Tumorzellen des Pankreas sind einerseits umgeben von einem schwer zu durchdringenden Stroma-Gewebe. Andererseits senden die Tumorzellen einen Botenstoff namens CXCL16 aus. Dieses CXCL16 lockt eine Gruppe von Immunzellen, die einen Angriff gegen den Tumor verhindern statt ihn loszutreten. Der Gruppe der T-Zellen, die den Tumor theoretisch bekämpfen können, fehlt der Rezeptor, der auf das CXCL16 Signal mit einem Angriff reagieren könnte. Deshalb setzen die Forscher CAR-T-Zellen ein. CAR-T steht für „chimärer Antigenrezeptor in T-Zellen“. Der Name beschreibt die gentechnischen Veränderungen, die aus T-Zellen aggressive Tumorkiller machen. Damit die Immunzellen die Krebszellen identifizieren, basteln Wissenschaftler mit gentechnischen Verfahren eine Art Antenne auf die Oberfläche der T-Zellen, die nach dem Schlüssel-Schloss-Prinzip ein ganz spezielles Molekül auf der Oberfläche der Tumorzellen erkennen. Mit Hilfe der Antenne spüren die T-Zellen die Krebszellen auf, docken an sie an und zerstören sie letztendlich. Um speziell die Zellen von Bauchspeicheldrüsentumoren anzusteuern, haben die Münchner Forscher zusätzlich das Gen für den fehlenden Rezeptor in die CAR-T-Zellen eingebaut. In allen Laborversuchen fanden die so ausgestatteten CAR-T-Zellen ihr Ziel und attackierten die Krebszellen von Pankreastumoren. Aktuell laufen die Vorbereitungen für klinische Versuche am Menschen.
Prognose
Mit den verbesserten Operationstechniken und der Chemotherapie sind die Heilungsraten etwas besser geworden. Die Prognose der Pankreaskarzinome ist jedoch immer noch eine der schlechtesten aller Karzinome: Neueren Untersuchungen zufolge liegt die Fünf-Jahres-Überlebensrate nach einem in kurativer Absicht durchgeführten Eingriff mit anschließender Chemotherapie bei 20 %, höchstens 30 %. Nur 10 bis 20 % der Tumoren sind zum Zeitpunkt der Diagnose noch operabel. Bei vier von fünf operierten Patienten kehrt der Tumor innerhalb von zwei Jahren zurück und nur in vereinzelten Fällen kann er ein zweites Mal entfernt werden. Inoperable Tumoren sprechen nur begrenzt auf eine Chemotherapie an; diese Patienten haben nur eine mittlere Überlebensdauer von vier bis sieben Monaten, die sich auch mit palliativer Chemotherapie nicht wesentlich verlängern lässt.
In dieser Situation liegt es in der Verantwortung der Onkologen, ihre therapeutischen Entscheidungen unter das Primat der subjektiven Lebensqualität des Patienten zu stellen. Dieser hermeneutische Endpunkt muss neben den mechanistischen Endpunkten wie Überlebensrate, Überlebenszeit, progressionsfreies Überleben etc. mindestens gleichwertig berücksichtigt werden. Das ärztliche Handeln sollte sich nach standardisierten Behandlungspfaden (clinical pathways) richten und sowohl die wissenschaftliche Evidenz als auch die Wirtschaftlichkeit berücksichtigen.
Für die Lebensqualität wichtige Faktoren sind eine adäquate, ausreichend hoch dosierte Schmerztherapie nach dem WHO-Stufenschema und fachkundige Hilfen zur psychologischen Krankheitsbewältigung. Best Supportive Care bedeutet, sich von unheilbaren Patienten nicht zurückzuziehen, sondern ihnen im Gegenteil jederzeit und dauerhaft medizinische Hilfe anzubieten. Beispielsweise ist es für Krebspatienten wichtig, sich möglichst lange normal ernähren zu können; dafür sind geeignete Diätprodukte zu verordnen und mechanische Hindernisse soweit möglich, auch mit palliativen Eingriffen, zu beheben. In der Endphase können zumindest für Brei- und Flüssignahrung passierbare Stents in den Darmtrakt eingesetzt werden oder es kann auf Sondenkost über eine PEG umgestellt werden. Neben dem Tumorschmerz ist Juckreiz ein weiteres sehr belastendes Symptom des fortgeschrittenen Pankreaskarzinoms, das in einem sorgfältigen Palliativkonzept durchaus gezielt und wirksam behandelt werden kann.
Darüber hinaus benötigen auch geheilte Patienten Betreuung. Wesentliche Ziele ihrer Rehabilitation sind Kostaufbau und Ernährungsberatung, Enzymsubstitution mit Verdauungsenzymen (Pankreatine, Pilzenzyme), Diabeteskontrolle und psychotherapeutische Stützungsmaßnahmen wie Gruppen- und Einzelgespräche. Sozialmedizinische Hilfen durch entsprechendes Fachpersonal sind Beratungen nach dem Schwerbehindertenrecht, Leistungen der beruflichen Rehabilitation, Häusliche Krankenpflege, Haushaltshilfe, Essensversorgung usw. Sie müssen noch im Krankenhaus im Rahmen eines geplanten Entlassungsmanagements eingeleitet werden.
Tierexperiment
2019 untersuchten englische Forscher Mäuse, die aufgrund einer vorhergehenden genetischen Manipulation besonders häufig an duktalen Adenokarzinomen des Pankreas erkrankten. Die Tumoren dieser Mäuse wiesen, wie dies auch bei menschlichen Tumoren der Fall war, eine tausendfache Anreicherung von natürlich im Darm vorkommenden Hefepilzen auf, wobei speziell Pilze der Gattung Malassezia hervortraten. In den Därmen der kranken Tiere oder im ganzen Verdauungssystem gesunder Mäuse kamen sie nur sporadisch vor. Bei gesunden Menschen ist die Malassezia auf die Hautoberfläche beschränkt, wo sie 80–90 % des lokalen Mikrobioms bildet.
Um die Rolle dieser Pilze zu verstehen, applizierten sie den Mäusen ein Fungizid (Amphotericin B oder Fluconazol), das die Pilze vernichtete. Überraschend war, dass das Tumorwachstum daraufhin zum Stillstand kam und eine Gabe von Chemotherapeutika (Gemcitabin) sogar eine Schrumpfung der Tumoren bewirken konnte. Eine (über den Darm vorgenommene) Wiederbesiedlung des Pankreas mit Malassezia-Arten (hier verwendet: Malassezia globosa) führte zum neuerlichen Fortschreiten der Erkrankung; keinen negativen Einfluss hatten Candida- und Aspergillusarten sowie Saccharomyces cerevisiae.
Die Frage war, wie die Malasseziapilze das Tumorwachstum beschleunigen konnten. Genexpressionsanalysen beim Menschen zeigten, dass die niedrige Überlebensrate der Erkrankung mit der Bildung des Proteins Mannose-bindendes Lektin (MBL) zusammenhängt, das im Rahmen der Immunabwehr an der Oberfläche von Mikroorganismen bindet und dadurch die Komplementkaskade auslöst. Dieser Vorgang, der die Mobilisation und das Wachstum von Immunzellen bewirkt, hat aber gleichzeitig zur Folge, dass sich auch Pankreaskrebszellen schneller teilen und beweglicher werden, der Tumor also wächst. Dies passierte aber nicht bei Mäusen, die kein MBL bildeten oder denen die C3-Komponente des Immunsystems fehlte.
Noch ist das Zusammenwirken dieser fatalen Abwehrreaktion gegen die Malassezia mit anderen Komponenten des Immunsystems (wie etwa die Interaktion mit dem Dectin-1-Signalweg) nicht verstanden, ebenso wenig wie die Rolle des bakteriellen Darmmikrobioms bei der Entstehung des duktalen Pankreaskarzinoms.
Literatur
- H. U. Baer, M. Wagner, M. W. Büchler: Onkologische Standardchirurgie des Pankreaskarzinoms. In: Chir Gastroenterol. Band 14, 1998, S. 42–48.
- Peter Bailey u. a.: Genomic analysis identify molecular subtypes of pancreatic cancer. In: Nature. Band 531, 3. März 2016, S. 47–52.
- Hans G. Beger, Markus W. Büchler, Henning Dralle, Markus M. Lerch, Peter Malfertheiner, Joachim Mössner, Jürgen F. Riemann: Erkrankungen des Pankreas: Evidenz in Diagnostik, Therapie und Langzeitverlauf. Springer-Verlag, 2013, ISBN 978-3-642-37964-2.
- M. Birth, Thomas Heinz Ittel, Philippe L. Pereira: Hepatobiliäre und Pankreastumoren. Springer-Verlag, 2010, ISBN 978-3-642-04935-4.
- F. T. Bosman, F. Carneiro, R. H. Hruban, N. D. Theise: WHO Classification of Tumours of the Digestive System. (= WHO Classification of Tumours. Band 3). 4. Auflage. WHO/IARC, 2010, ISBN 978-92-832-2432-7.
- R. Grützmann u. a.: Intraduktale papillär-muzinöse Neoplasie des Pankreas: Aktueller Stand von Diagnostik, Therapie und Prognose. In: Dtsch Arztebl Int. Nr. 108 (46), 2011, S. 788–794 (Übersichtsarbeit).
- T. Seufferlein, J. B. Bachet u. a.: Pancreatic adenocarcinoma: ESMO-ESDO Clinical Practice Guidelines for diagnosis, treatment and follow-up. In: Annals of Oncology. Band 23, Suppl. 7, Oktober 2012, ISSN 1569-8041, S. vii33–vii40, doi:10.1093/annonc/mds224. PMID 22997452.
- Karl Vossschulte, Franz Xaver Sailer, K. Schultis: Diagnose und Therapie benigner Pankreastumoren. In: Deutsche medizinische Wochenschrift. Band 96, 1971, S. 1461 ff.
- K. Zimmermann: Bauchspeicheldrüse. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 89–106, hier: S. 98–100 (Pankreasgeschwülste).
Weblinks
- S3-Leitlinie Exokrines Pankreaskarzinom, AWMF-Registernummer 032-010OL, Stand 31. Dezember 2021, gültig bis 31. Juli 2024
- Informationsseite und „blauer Ratgeber“ (PDF; 1017 kB) Patientenbroschüre, aktualisiert Stand 12/2017, Stiftung Deutsche Krebshilfe und der Deutschen Krebsgesellschaft, abgerufen am 8. Dezember 2018.
- Kampagne „Aus der Mitte – Diagnose Bauchspeicheldrüsenkrebs“ von Hoffmann-La Roche
- Selbsthilfeverein Tumore und Erkrankungen der Bauchspeicheldrüse e. V.
- Pancreatic Cancer. NCCN Guidelines for patients. (PDF) National Comprehensive Cancer Network, Januar 2014 (englisch)
- Pancreatica:Confronting pancreatic cancer. Cancer Patients Alliance, US-amerikanische Stiftung (englisch)
- Liste der DGAV-zertifizierten Zentren für Pankreaschirurgie in Deutschland
- Häufige Krankheiten – modern behandelt: Bauchspeicheldrüsenkrebs. In: nzz.ch. 21. Februar 2013, abgerufen am 17. Januar 2015.
- Sonografisches Bild eines Pankreaskarzinoms