Borate
Borate sind Salze oder Ester der Borsäuren. Die Salze sind dadurch gekennzeichnet, dass sie in ihrem Ionengitter als Anion das Borat-Ion BO33− bzw. eine kondensierte Form davon (z. B. B4O5(OH)42−, Tetraborat) enthalten.
Borate bilden eine eigenständige Mineralklasse.
Inhaltsverzeichnis
Natürliches Vorkommen
Der Abbau von Bor-haltigen, meist kristallwasserhaltigen Mineralien wird als Boratabbau bezeichnet. Folgende Minerale sind wichtige, in Industrie und Technik verwendete Borate:
- Boracit (Magnesium-chlor-borat, wasserfrei)
- Borax (Natriumtetraborat)
- Priceit (Pandermit) (Calciumborat)
- Colemanit (Calciumborat)
- Sassolin (Borsäure)
- Kernit (Natriumtetraborat)
- Ulexit (Calcium-Natrium-Borat)
Darstellung
Eine einfache Darstellung von Boraten ist die Reaktion von Orthoborsäure mit Natronlauge (Natriumhydroxid-Lösung):
Eigenschaften
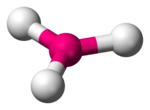
Das isolierte Borat-Ion BO33− liegt laut dem VSEPR-Modell trigonal-planar vor (vgl. Abbildung).
Es existiert eine Vielfalt an Strukturvariationen bei den Boraten; beispielsweise das Dimer B2O54− oder das bereits erwähnte Tetraborat B4O5(OH)42−.
Darüber hinaus existieren verschiedene Metaborate, die sich von der Metaborsäure ableiten und die allgemeine Formel (BO2)nn− haben. Sie können sowohl ringförmige als auch polymere Kettenstrukturen ausbilden.
Durch Reaktion von Borsäure mit mehrwertigen Alkoholen (beispielsweise Glycerin oder Mannitol) kann man cyclische Ester (Chelat-Komplexe) erhalten.
Borate, bei denen ein Sauerstoffatom durch eine Disauerstoffgruppe ersetzt sind, werden Perborate oder Peroxoborate genannt.
Toxikologie
Gentoxische oder karzinogene Wirkungen von Bor wurden bislang nicht nachgewiesen. Borate werden vom Organismus ausgeschieden und sammeln sich nicht an. Eine Aufnahme durch die Haut findet nicht statt. Bei Natriumtetraboraten (insbesondere Borax) wird (ebenso wie bei Borsäure) von einer Reproduktionstoxizität ausgegangen. Dies wurde bei der Verabreichung von höheren Dosen an Mäuse beobachtet.
Nachweis
Für den qualitativen Schnellnachweis von Boraten gibt man die zu untersuchende Substanz in ein Reagenzglas oder Porzellanschälchen, fügt Methanol und wenige Tropfen konzentrierte Schwefelsäure hinzu, wobei Borsäuretrimethylester entsteht. Die aufsteigenden Dämpfe des Methanols, die auch den Borsäureester enthalten, sind entzündlich und brennen mit grüner Flamme.
Die Anwesenheit von zweiwertigen Kupfer-Ionen kann den Nachweis stören.
Zum quantitativen Nachweis von Boraten in der analytischen Chemie eignet sich die Curcumin-Methode. Curcumin und Borsäure bilden den rot-gefärbten Komplex Rosocyanin, dessen Konzentration kolorimetrisch bestimmt wird. Die Curcumin-Methode eignet sich deshalb auch zur quantitativen Bestimmung von Bor nach oxidativem Aufschluss einer Probe des Bor-haltigen Materials.
Verwendung
Verschiedene Formen von Boraten werden in Holzschutzmitteln verwendet. Borate werden auch als Puffersubstanzen (siehe: Pufferlösung) eingesetzt. Perborate finden in Wasch- und Bleichmitteln Einsatz.
Literatur
- Erwin Riedel, Christoph Janiak: Anorganische Chemie. 7. Auflage. de Gruyter, Berlin 2007, ISBN 978-3-11-018903-2, S. 582 ff.
- Arnold Willmes: Taschenbuch Chemische Substanzen. 3. Auflage. Verlag Harri Deutsch, Frankfurt am Main 2007, ISBN 978-3-8171-1787-1, S. 213 ff.