- Bovine Meat and Milk Factors
- BRCA1
- BRCA2
- Brustkrebs
- Brustkrebsmonat Oktober
- Breast Cancer Research and Treatment
- Clinical Breast Cancer
- Duktales Karzinom in situ
- Brustkrebs
- Invasives duktales Karzinom
- Invasives lobuläres Karzinom
- Lobuläres Karzinom in situ
- Lumpektomie
- MCF-7
- Paget-Karzinom
- Prophylaktische Mastektomie
- Wächterlymphknoten
- Stewart-Treves-Syndrom
- Röntgentomographie
Brustkrebs

| Klassifikation nach ICD-10 | |
|---|---|
| C50 | Mammakarzinom |
| C50.0 | Brustwarze und Warzenhof |
| C50.1 | Zentraler Drüsenkörper der Brustdrüse |
| C50.2 | Oberer innerer Quadrant der Brustdrüse |
| C50.3 | Unterer innerer Quadrant der Brustdrüse |
| C50.4 | Oberer äußerer Quadrant der Brustdrüse |
| C50.5 | Unterer äußerer Quadrant der Brustdrüse |
| C50.6 | Recessus axillaris der Brustdrüse |
| C50.8 | Brustdrüse, mehrere Teilbereiche überlappend |
| C50.9 | Brustdrüse, nicht näher bezeichnet |
| ICD-10 online (WHO-Version 2019) | |

Brustkrebs oder Mammakarzinom (von lateinisch mamma „Zitze, Brust; weibliche Brustdrüse“) ist der häufigste bösartige Tumor der Brustdrüse des Menschen. Er kommt hauptsächlich bei Frauen vor; nur etwa jede hundertste dieser Krebserkrankungen tritt bei Männern auf. In den westlichen Staaten ist Brustkrebs die häufigste Krebsart bei Frauen. Am Brustkrebs sterben mehr Frauen als an irgendeiner anderen Krebserkrankung. Die meisten Erkrankungen treten sporadisch (zufällig) auf, es gibt aber sowohl erbliche als auch erworbene Risikofaktoren. Neben der Heilung sind der Erhalt der betreffenden Brust und vor allem der Lebensqualität erklärtes Ziel der medizinischen Behandlung.
Die Therapie besteht in der Regel in einer an das Erkrankungsstadium angepassten Kombination aus Operation sowie Zytostatika-, Hormon- und Strahlentherapie. Neue Ansätze aus dem Gebiet der Krebsimmuntherapie werden außerdem durch monoklonale Antikörper (wie z. B. durch die Verabreichung von Trastuzumab oder Pertuzumab) ermöglicht. Das medizinische Vorgehen basiert in hohem Maß auf Erfahrungen aus Studien, folgt oft der evidenzbasierten Medizin und ist in weltweit akzeptierten Leitlinien standardisiert. Zahlreiche nationale und internationale Programme zur Früherkennung und zur strukturierten Behandlung sollen die Letalität (Sterblichkeit) künftig senken.
Inhaltsverzeichnis
- 1 Epidemiologie
- 2 Ursachen und Risikofaktoren
- 3 Einfluss der Ernährung
- 4 Früherkennung und Screening
- 5 Diagnose
- 6 Klassifikation
- 7 Therapie
- 8 Geschichte
- 9 Brustkrebszeichen in der Kunst
- 10 Literatur
- 11 Weblinks
- 12 Einzelnachweise
Epidemiologie
Brustkrebs bei der Frau
In Deutschland ist das Mammakarzinom mit einem Anteil von 32 % aller Krebsneuerkrankungen die häufigste Krebserkrankung bei Frauen. Das Lebenszeitrisiko wird mit 12,9 % angegeben, d. h. etwa jede achte Frau erkrankt im Laufe ihres Lebens an Brustkrebs. Dies sind in Deutschland etwa 71.900 Neuerkrankungen pro Jahr (2019) oder 171 Fälle pro 100.000 Einwohner und Jahr.
Die Weltgesundheitsorganisation (WHO) gab zum Weltkrebstag im April 2021 bekannt, dass im Jahr 2020 weltweit 19,3 Millionen Menschen an Krebs erkrankten. Als häufigste Krebsart sei Brustkrebs registriert worden, gefolgt von Lungenkrebs. Die Zahl von derzeit rund 20 Millionen Krebs-Neuerkrankungen könnte laut WHO bis 2040 auf etwa 30 Millionen weltweit ansteigen. Für Deutschland prognostizierte die Deutsche Krebshilfe einen Anstieg auf rund 600.000 Krebsfälle im Jahr 2030. Auf Basis von aktuellen Erkrankungszahlen und der erwarteten demografischen Entwicklung haben Wissenschaftler der Internationalen Agentur für Krebsforschung (IARC) und von anderen Instituten im Fachmagazin The Breast eine Prognose für die globale Häufigkeit der Erkrankung aufgestellt: Bis 2040 werde die Krankheitslast weiter zunehmen. Die Autoren gehen dann von über drei Millionen Neuerkrankungen (+40,8 % im Vergleich zu 2020) und einer Million Todesfällen (+51,9 %) pro Jahr aus – allein schon wegen der wachsenden und immer älter werdenden Weltbevölkerung.
Bei internationalen Vergleichen muss die unterschiedliche Altersverteilung der nationalen Bevölkerungen berücksichtigt werden. Die nach dem sogenannten Europastandard (ESR) altersstandardisierte Inzidenz (Neuerkrankungsrate) lag in Deutschland im Jahr 2010 für Frauen bei 119,6/100.000. Die brustkrebsbedingte Sterberate (Mortalität) betrug im selben Jahr altersstandardisiert 24,0/100.000 nach dem ESR. Seit 1970 haben sich die Erkrankungszahlen verdoppelt, während die Mortalität eher rückläufig ist.
Brustkrebs ist weltweit die häufigste invasive Tumorerkrankung bei Frauen. Weltweit gibt es nach Schätzungen der WHO (2003) etwa 1.050.000 neue Erkrankungsfälle pro Jahr, davon 580.000 in den Industriestaaten. Vergleichsweise seltener ist die Erkrankung in Afrika und Asien. Weltweit starben 1998 circa 412.000 Frauen an Brustkrebs, das sind 1,6 % aller gestorbenen Frauen. Damit ist Brustkrebs weltweit die häufigste krebsbedingte Todesursache bei Frauen. In der westlichen Welt ist Brustkrebs bei Frauen zwischen dem 30. und 60. Lebensjahr die häufigste Todesursache überhaupt.
In Deutschland schätzt man etwa 17.460 brustkrebsbedingte Todesfälle pro Jahr und in den Vereinigten Staaten etwa 40.200. In Deutschland beträgt die durchschnittliche Fünfjahresüberlebensrate zurzeit 86–90 %. Während jedoch in den reichen Ländern die Sterberate sinkt, ist sie in den ärmeren Ländern hoch. Dies hängt zum einen mit der immer höheren Lebenserwartung zusammen, zum anderen mit den schlechteren diagnostischen und therapeutischen Möglichkeiten in den ärmeren Ländern. WHO-Angaben zufolge starben 2007 etwa 72 Prozent aller an Krebs erkrankten Menschen in Ländern mit mittlerem und niedrigem Einkommen. Dennoch gab es 2013 in den Vereinigten Staaten das Phänomen von steigenden Brustkrebsraten bei jungen Frauen, für die es bisher keine zufriedenstellende Erklärung gibt.
| Anzahl der in Deutschland am Mammakarzinom verstorbenen Frauen nach Altersgruppen | ||||
| Alter | 2003 | 2004 | 2005 | 2006 |
|---|---|---|---|---|
| 0–30 | 16 | 20 | 16 | 13 |
| 30–40 | 348 | 318 | 294 | 294 |
| 40–50 | 1.271 | 1.296 | 1.283 | 1.176 |
| 50–60 | 2.493 | 2.404 | 2.419 | 2.489 |
| 60–70 | 4.158 | 4.441 | 4.252 | 4.035 |
| 70–80 | 4.140 | 4.354 | 4.273 | 4.283 |
| >80 | 4.747 | 4.759 | 4.918 | 4.996 |
| Gesamt | 17.173 | 17.592 | 17.455 | 17.286 |
| Anteil der Todesursache „Mammakarzinom“ in Prozent nach Altersgruppen (nur Frauen, Deutschland) | ||||
| Alter | 2003 | 2004 | 2005 | 2006 |
|---|---|---|---|---|
| 0–30 | 0,4 | 0,5 | 0,5 | 0,4 |
| 30–40 | 10 | 11 | 10 | 11 |
| 40–50 | 13 | 14 | 14 | 13 |
| 50–60 | 14 | 14 | 13 | 14 |
| 60–70 | 9 | 10 | 10 | 10 |
| 70–80 | 4 | 5 | 4 | 5 |
| >80 | 2 | 2 | 2 | 2 |
Brustkrebs beim Mann
Männer erkranken seltener an Brustkrebs. In Uganda sind fünf Prozent aller Mammakarzinompatienten männlich, in Sambia liegt der Anteil sogar bei 15 Prozent. Nach aktueller Statistik 2019 sind es in Deutschland jährlich etwa 700 Männer. Das Verhältnis von Erkrankungen bei Männern zu Frauen liegt bei 1:100. Die standardisierten globalen Inzidenzraten für Brustkrebs betrug bei Männern 0,40 pro 105 Personenjahre (66,7 pro 105 bei Frauen). Die Diagnosestellung erfolgt bei Männern in einem höheren medianen Alter (69,6 Jahre). Männliche Patienten weisen zwar eine schlechtere relative 5-Jahres-Überlebensrate auf als Frauen (0,72 [95 % KI: 0,70–0,75] bzw. 0,78 [95 % KI: 0,78-0,78]), was einem relativen erhöhten Mortalitätsrisiko von 1,27 (95 % KI: 1,13–1,42) entspricht, sie zeigen jedoch nach Anpassung um Alter und Jahr der Diagnosestellung, Stadium und Therapie ein signifikant besseres relatives Brustkrebs-assoziiertes Überleben als Patientinnen. Die Mortalität bei Männern liegt bei rund 200 Todesfällen pro Jahr. Eine Studie der European Organisation for Research and Treatment of Cancer (EORTC) zusammen mit anderen Fachverbänden aus Europa und Nordamerika soll die Ursachen für diese Geschlechterdifferenz detailliert aufklären.
Risikofaktoren für Brustkrebs bei Männern
Die Häufigkeit von Brustkrebs bei Männern wird durch demographische, genetische, umweltbedingte und endokrine Faktoren gesteigert:
| Gruppe | Risikofaktor |
|---|---|
| Demographie | höheres Alter |
| Afroamerikaner | |
| familiäres Risiko | |
| Genetik | BRCA2 |
| BRCA1 | |
| CHEK2 | |
| PALB2 | |
| Umwelt | Strahlenexposition |
| Endokrine Faktoren | Östradiol im Serum erhöht |
| Klinefelter-Syndrom | |
| Gynäkomastie | |
| Leberfunktionsstörung | |
| Fettsucht | |
| Störung der Hodenfunktion |
Anmerkungen: CHEK2 ist an der DNA-Reparatur beteiligt. Das Gen kodiert eine Zellzyklus-Checkpoint-Kinase. PALB2 wird Partner und Lokalisierer von BRCA2 genannt. Das Gen kodiert ein Protein, welches mit dem Brustkrebsrisikofaktor BRCA2 interagiert.
Den Aufbau und die Betreuung des 2010 in der Bundesrepublik gebildeten ersten Selbsthilfe-Netzwerks „Netzwerk Männer mit Brustkrebs e. V.“ hat die bundesweite Frauenselbsthilfe nach Krebs (FSH) in Bonn unter dem Patronat der Stiftung Deutsche Krebshilfe übernommen. Neben dem Netzwerk Männer mit Brustkrebs und dem Infonetz Krebs bietet auch der Krebsinformationsdienst Informationen zu diesem Thema.
Symptome für eine Erkrankung sind Flüssigkeitsabsonderung aus der Brustwarze, kleine Entzündungen oder Wunden, die nicht abheilen oder eine Einziehung der Brusthaut an einer Stelle oder der Brustwarze.
Zur Behandlung können in einer Operation sowohl tumorverdächtige Bereiche wie auch benachbarte Lymphknoten aus der Achselhöhle entnommen werden. Über solche Lymphknoten können sich Tumorzellen am ehesten im Körper ausbreiten. Möglich ist auch eine Strahlentherapie der Brustwand und eventuell eine Chemotherapie. Auch bei Männern kann eine antihormonelle Therapie sinnvoll sein, wenn ihr Tumor östrogenabhängig wächst, und/oder eine Therapie mit Antikörpern, die sich gegen besondere Merkmale mancher Brustkrebszellen richten. Männer bilden auch das Hormon Östrogen, jedoch in sehr viel geringerem Maße als Frauen.
Ursachen und Risikofaktoren
Genetische Risikofaktoren
Etwa 5 bis 10 % der Brustkrebserkrankungen können erblich bedingt sein. Nur bei einer kleinen Gruppe von Frauen (etwa 1 pro 500) findet man definierte, krankheitsverursachende Mutationen. Wesentlich häufiger sind genetische Veränderungen, die die Suszeptibilität (Empfänglichkeit) für Brustkrebs auf äußere Faktoren erhöhen.
Die höchste Wahrscheinlichkeit, an der erblichen Form des Brustkrebs zu erkranken, besteht bei Frauen mit Mutation in den Genen BRCA1 und BRCA2 (BRCA1/2 = Breast Cancer Gene 1/2). Es kommt bereits bei einer Mutation in einem Allel dieser Gene zur Erkrankung (man spricht von sogenannten Tumorsuppressorgenen mit autosomal-dominantem Erbgang). Die Wahrscheinlichkeit, im Laufe des Lebens an Brustkrebs zu erkranken, wird für Trägerinnen des mutierten BRCA1 mit 65 %, für Trägerinnen des mutierten BRCA2 mit 45 % angegeben.
Mutationen im p53-Gen, einem der Tumorsuppressorgene, werden autosomal-dominant vererbt (Li-Fraumeni-Syndrom). Weitere Genveränderungen, die das Risiko erhöhen, betreffen Mutationen von PTEN (Cowden-Syndrom), STK11 (Peutz-Jeghers-Syndrom) und CDH1 (E-Cadherin); deren Häufigkeit und Risikoerhöhung für die Brustkrebserkrankung ist jedoch nicht genau bekannt. Mäßig erhöht ist die Wahrscheinlichkeit bei Bestehen der seltenen genetischen Veränderungen mit mittlerer Penetranz, diese betreffen unter anderem die folgenden Gene: ATM (Ataxia teleangiectatica), CHK2 (checkpoint kinase 2) und BRIP-1. Insgesamt lassen sich nicht mehr als fünf Prozent der Brustkrebserkrankungen auf diese Genveränderungen mit hohem oder mittlerem Risiko zurückführen.
Die wesentlich häufigeren Allelveränderungen mit geringer Penetranz erhöhen das Brustkrebsrisiko höchstens auf das 1,25-fache bei heterozygoten Veränderungen und auf das 1,65-fache bei homozygoten Veränderungen. Dazu gehören insbesondere Veränderungen von FGFR2 (fibroblast growth factor receptor 2) und auf dem Chromosom 2q. Es wird geschätzt, dass solche Mutationen mit geringer Penetranz bei 58 % der Brustkrebserkrankungen eine Rolle spielen.
Die Wahrscheinlichkeit, selbst zu erkranken, steigt statistisch nachweisbar ab zwei an Brustkrebs Erkrankten in der direkten Verwandtschaft an. Familien, in denen mehrere Personen an Brust- oder Eierstockkrebs erkrankt sind, wird eine tumorgenetische Beratung in einem Beratungszentrum, beispielsweise aus dem Verbundprojekt familiärer Brustkrebs der Deutschen Krebshilfe empfohlen.
Bei Frauen mit einer entsprechenden Prädisposition (hohe Wahrscheinlichkeit des Krankheitsauftretens) kann auf Wunsch eine beidseitige prophylaktische Mastektomie (Brustamputation) und/oder eine Eierstockentfernung vorgenommen werden: Einen gewissen Schutz vor einer Brustkrebserkrankung scheint die weitgehende Unterbindung der Östrogenproduktion durch die Entfernung beider Eierstöcke zu bieten. Verschiedene Autoren berichten von einer Verringerung des Erkrankungsrisikos von 50 bis 70 %, wenn in der Familie bereits Brustkrebs auftrat.
Hormonelle Faktoren
Menschliche Körperzellen, auch Tumorzellen, tragen Rezeptoren für die Sexualhormon-Gruppen Estrogene und Gestagene. Mammakarzinome mit Estrogen- und/oder Gestagen-Rezeptoren können durch eine endokrine Therapie, z. B. Tamoxifen, in ihrem Wachstum gebremst werden. Es wird diskutiert, ob Estrogene und Gestagene die Entstehung von Brustkrebs beeinflussen. Durch eine Blockierung des Estrogen-Rezeptors mit Tamoxifen konnte die Häufigkeit von Brustkrebserkrankungen (Inzidenz) gesenkt werden. Es wurde nur die Häufigkeit von Mammakarzinomen mit Rezeptoren gesenkt. Rezeptor-negative Karzinome wurden nicht beeinflusst. Neben Tamoxifen könnten auch Raloxifen und Exemestane die Inzidenz von Brustkrebs senken. Für den klinischen Einsatz müssen Risiken und Nebenwirkungen sorgfältig abgewogen werden. Eine mehrjährige Hormonersatztherapie gegen Wechseljahresbeschwerden mittels östrogen- und gestagenhaltiger Medikamente kann das Erkrankungsrisiko um bis zu 45 % erhöhen. In der Women’s Health-Initiative war das relative Brustkrebsrisiko 1,26 (Vertrauensbereich 1,00-1,59) nach postmenopausaler Einnahme von Östrogenen und Gestagenen. Auch Frauen mit früher Menarche (erstes Auftreten der Regelblutung in der Pubertät) und später Menopause (Ende der Menstruation, „Wechseljahre“) tragen ein etwas höheres Erkrankungsrisiko. Frauen, die früh Kinder bekommen und lange stillen, haben dagegen ein niedrigeres Risiko.
Inwieweit die Antibabypille das Risiko erhöht, ist ebenso substanz- und dosisabhängig wie bei Hormonersatztherapien und daher nicht allgemein bezifferbar. Die Nurses’ Health Study und weitere Studien konnten jedoch eine typische Erhöhung des Risikos auf das 1,2- bis 1,4-fache nach einer Einnahme der Pille über mehr als fünf Jahre zeigen.
Schwangerschaftsabbrüche erhöhen das Brustkrebsrisiko einer Metaanalyse aus dem Jahr 2004 zufolge nicht. Auch in anderen Studien mit hohen Fallzahlen konnte man einen solchen Zusammenhang nicht nachweisen.
Linkshändigkeit
Eine Studie, in der festgestellt wurde, dass Linkshänderinnen ein bis zu doppelt so hohes Risiko haben, vor der Menopause an Brustkrebs zu erkranken als Rechtshänderinnen, sorgte im September 2005 für erhöhtes öffentliches Interesse. Schon fünf Jahre zuvor war eine andere Studie zu einem ähnlichen Ergebnis gekommen (Risikozunahme +42 %). Eine Studie aus dem Jahr 2007 kommt sogar auf eine um den Faktor 2,59 erhöhte Brustkrebswahrscheinlichkeit bei Linkshänderinnen.
Die Mechanismen für das erhöhte Brustkrebsrisiko bei Linkshänderinnen sind noch weitgehend ungeklärt. Eine in Fachkreisen diskutierte Hypothese besagt, dass eine pränatale Einwirkung von erhöhten Dosen von Sexualhormonen auf den Embryo die Ursache ist. Die Sexualhormone bewirken dabei – so die Hypothese – zum einen, dass das Kind linkshändig wird und zum anderen, dass sich das Brustgewebe verändert und anfälliger für eine Krebserkrankung wird. Die Linkshändigkeit ist dabei gewissermaßen ein Indikator für erhöhte Konzentrationen an Steroiden in der Gebärmutter. Die Hypothese, dass die Grundlage für die Entstehung von Brustkrebs durch die Einwirkung von Sexualhormonen im embryonalen Stadium gebildet werden kann, wird schon seit 1990 diskutiert und basiert auf dem Geschwind-Behan-Gallura-Modell. Dass Sexualhormone – insbesondere Testosteron – in utero einen Einfluss auf die Ausbildung der Händigkeit haben können, wurde bereits 1985 gezeigt.
Linke Brust häufiger als rechte Brust
Statistisch gesehen ist die linke Brust, sowohl bei Frauen als auch Männern, häufiger von Brustkrebs betroffen als die rechte. Davon sind alle Populationen betroffen. Mit zunehmendem Alter wird der Unterschied noch größer. Diese für die linke Brust erhöhte Rate trifft offensichtlich nicht für Tumoren zu, die ihren Entstehungsort im oberen äußeren Quadranten haben. Die Wahrscheinlichkeit, dass die linke Brust an Krebs erkrankt, ist – je nach Studie – um fünf bis sieben Prozent höher als bei der rechten. Bei Männern liegt dieser Wert sogar bei zehn Prozent.
Die Ursachen für dieses Phänomen sind noch weitgehend unklar. Diskutiert werden unter anderem Schlafgewohnheiten,Händigkeit, Unterschiede in der Brustgröße und den Gehirnstrukturen sowie Präferenzen beim Stillen. Eine andere Hypothese sieht in der embryonalen Entwicklung des auf der linken Körperseite befindlichen Herzens eine mögliche Ursache.
Bei anderen Organen, wie beispielsweise der Lunge und den Hoden, ist eine ähnliche statistische Häufung zu beobachten. Bei diesen beiden Organen ist die Wahrscheinlichkeit, dass die rechte Hälfte des Organs betroffen ist, um 13 % höher. In diesen Fällen erklärt man sich diesen Unterschied durch das meist kleinere Gewebevolumen der linken Organhälfte.
Weitere Faktoren
Einige weitere Faktoren scheinen einen Effekt auf die Brustkrebsentwicklung zu haben:
- Ionisierende Strahlung in jungen Jahren erhöht das spätere Brustkrebsrisiko. Mammographie-Untersuchungen bei Frauen über 40 Jahren führen zu keiner bedeutsamen Risikosteigerung.
- Starkes und langdauerndes Zigarettenrauchen erhöht die Erkrankungswahrscheinlichkeit um 30 %.
- Patientinnen mit Brustkrebs gaben 2017 bei einer Befragung deutlich häufiger als Frauen in einer (gesunden) Kontrollgruppe Symptome an, die in ihrer Häufung charakteristisch für ein Flammer-Syndrom sind, vor allem kalte Extremitäten, Schmerzempfindlichkeit, gestörte Wärmeregulation (sie frieren leicht), niedriger Blutdruck und rötliche Hautflecken.
- Seit einigen Jahren wird außerdem eine aktive Rolle von Endothelin und Endothelin-konvertierendem Enzym (ECE) im Rahmen der Brustkrebsentstehung und insbesondere der Metastasierung von Brustkrebszellen diskutiert.
- Durch Bewegungsmangel steigt die Erkrankungswahrscheinlichkeit bei Frauen um etwa 25 %.
Brustkrebsauslösung durch eine Infektion („Brustkrebsvirus“) wurde bisher nicht nachgewiesen. Brustimplantate verursachen keinen Brustkrebs, ebenso wenig wie das Tragen von Büstenhaltern.
Einfluss der Ernährung
Deutlich übergewichtige Frauen erkranken 2,5 mal so häufig wie normalgewichtige.
Längere Beobachtungsstudien zeigten für Omega-3-Fettsäuren aus fetthaltigen Fischen zwar einen protektiven Effekt, in einer neuen Studie wird jedoch klar, dass die Protektion nur geringgradig ist.
Phytoöstrogene sind Pflanzeninhaltsstoffe mit östrogenartiger Wirkung. Es wurde daher spekuliert, ob Ernährungsformen, die reich an solchen Stoffen sind (etwa auf Sojabasis), das Erkrankungsrisiko beeinflussen. Es gibt verschiedene denkbare Wege, wie Isoflavone aus Soja schützend wirken könnten. Etwa indem sie den Menstruationszyklus verlängern, eine Veränderung des Hormonhaushaltes bewirken oder ein Einfluss auf Tumoren haben, die in Abhängigkeit zu Östrogenrezeptoren stehen. In Studien zeigte Sojakonsum sowohl einen präventiven Effekt als auch positive Auswirkungen nach einer Brustkrebsdiagnose. Eine Studie unter chinesischen Frauen zeigte dabei einen Dosiseffekt: 10 mg mehr Soja-Isoflavone am Tag reduzierten das Risiko an Brustkrebs zu erkranken um 3 %. Das Deutsche Krebsforschungszentrum sah 2019 keine ausreichende Grundlage, um von einer schützenden Wirkung von Soja gegenüber Brustkrebs sprechen zu können.
Frauen, die täglich mindestens 20 g Alkohol trinken, tragen ein um 30 % erhöhtes Risiko, an einem Mammakarzinom zu erkranken, möglicherweise wegen des höheren Sexualhormonspiegels.
Geringe Iodaufnahme könnte ebenfalls eine Rolle spielen. In Ländern mit hohem Iodgehalt in der Nahrung (z. B. Japan) kommt es zu erheblich weniger Brustkrebsfällen als in Iodmangelgebieten. Neben dieser Korrelation werden auch konkretere Stoffwechselzusammenhänge vermutet.
Ein weiterer Risikofaktor könnte Sonnen- bzw. Vitamin-D-Mangel sein. Wenn (postmenopausale) Frauen zur Vorbeugung gegen Knochenbrüche Calcium und Vitamin D einnehmen, scheint deren Erkrankungsrisiko stark zu sinken. Diese Studien werden sehr kontrovers diskutiert. In einigen Fällen scheint es klare Anzeichen eines Publikationsbias zu geben. In einer 2013 durchgeführten Metastudie konnte kein signifikanter Zusammenhang zwischen der Einnahme von Vitamin D und einem reduzierten Brustkrebsrisiko bei postmenopausalen Frauen festgestellt werden.
Auch wer im jungen Erwachsenenalter viel rotes Fleisch zu sich genommen hat, hat einer Kohortenstudie zufolge ein erhöhtes Brustkrebsrisiko.
Eine Metastudie aus dem Jahr 2017 kommt zu dem Schluss, dass der Konsum von gesättigten Fetten die Überlebenschance bei Brustkrebs negativ beeinflusst.
Früherkennung und Screening
Etwa 80 bis 90 % aller Geschwulste in der weiblichen Brust wurden bisher von den Frauen selbst zufällig entdeckt. Diese tast- und sichtbaren Tumoren sind bei ihrer Entdeckung oft schon relativ groß und sind deshalb meist mit einer schlechten Prognose verbunden. Durch konsequente Früherkennung kleinerer, nicht tastbarer Tumoren könnte die Sterblichkeit großen Studien zufolge um 25 % gesenkt werden. Zur Früherkennung dienen Programme zur systematischen Selbstuntersuchung und der Mammasonographie sowie die Screening-Mammographie. Der medizinische Nutzen der Früherkennung ist umstritten. Eine 2013 veröffentlichte Meta-Studie in der Cochrane-Bibliothek von über 600 000 Frauen ergab keinen Überlebensvorteil für Frauen, die an der Früherkennung teilnahmen. Dies wurde auch in einer kanadischen Studie von 2014 an 45 000 Frauen, die 25 Jahre beobachtet wurden, bestätigt.
Selbstuntersuchung
Systematische Schulungen der Frauen zur Brust-Selbstuntersuchung sind in ihrem Nutzen umstritten. Nicht jede Brustkrebserkrankung führt zu einer tastbaren Geschwulst. Umgekehrt ist nur etwa jede zwölfte selbst ertastete Veränderung bösartig. Studien zufolge senkt die systematische Selbstuntersuchung der Brust die Sterblichkeit nicht. Die US-amerikanische Preventive Services Task Force (USPSTF) gibt wegen der unzureichenden Datenlage keine Empfehlung für oder gegen die Brustselbstuntersuchung. Die kanadische Task Force on Preventive Health Services gab 2001 eine Empfehlung gegen die Selbstuntersuchung ab, weil die Entdeckungsrate schlecht und falsch positive Befunde häufig seien.
Zum Erlernen der Selbstuntersuchung gibt es Brustmodelle aus Silikon, die verschiedene Knotentypen enthalten; beigefügt sind Begleitvideo und Anleitung. Jedoch ist dies in Deutschland keine Leistung der gesetzlichen Kranken- oder Pflegeversicherung.
In Deutschland wird die Selbstuntersuchung von den medizinischen Fachgesellschaften empfohlen, weil sie zur Bewusstseinsbildung der Frauen beitrage und so die eigentliche Früherkennung durch apparative Verfahren begünstige. Die Selbstuntersuchung, die monatlich zirka fünf bis sieben Tage nach Einsetzen oder kurz nach dem Ende der Regelblutung durchgeführt werden soll, erfolgt nach einem bestimmten, sich immer wiederholenden Muster. Bei ertasteten Auffälligkeiten sollen Frauen einen Facharzt aufsuchen.
Ärztliche Krebsfrüherkennung
Die klinische Untersuchung der Brust durch einen Arzt ist Bestandteil des gesetzlichen Krebs-Früherkennungsprogramms ab dem 30. Lebensjahr. Für die Aussagefähigkeit der ärztlichen Tastuntersuchung gilt im Prinzip dieselbe Einschränkung wie für die Selbstuntersuchung.
Brustkrebsfrüherkennung durch Blinde
Blinde Menschen verfügen in der Regel über einen überdurchschnittlich trainierten Tastsinn. Diese besondere Fähigkeit wird für die Früherkennung von Brustkrebs genutzt. Im Rahmen des in Nordrhein-Westfalen angesiedelten Modellprojektes „Discovering hands“ (Entdeckende Hände) wurde der Ausbildungskurs der Medizinischen Tastuntersucherin geschaffen.
Bildgebende Verfahren
Die Röntgen-Mammographie ist einer S3-Leitlinie von 2010 zufolge zurzeit die einzige für die Erkennung von Brustkrebsvorstufen oder frühen Tumorstadien allgemein als wirksam anerkannte Methode. Die Mamma-Kernspintomographie ist möglicherweise überlegen, jedoch für ein Massenscreening zu teuer. In Deutschland wurde deshalb ein qualitätsgesichertes Mammographie-Screening-Programm auf der Grundlage der „Europäischen Leitlinien für die Qualitätssicherung des Mammographie-Screenings“ für Frauen von 50 bis 69 Jahren aufgebaut. Dazu wurde Deutschland in 94 Regionen aufgeteilt, für die jeweils eine Screening-Einheit verantwortlich ist. In den USA gab es 2002 die Empfehlung, das Mammographiescreening bereits mit 40 Jahren zu beginnen.
Durch Dreifachbefundung und weitere Diagnostik soll erreicht werden, dass möglichst wenige gutartige Mammatumoren biopsiert oder gar entfernt werden. Die EUREF-Richtlinie verlangt, dass in mindestens 50 % der genommenen Gewebeproben bösartige Tumoren nachgewiesen werden können; in manchen Untersuchungsprogrammen werden bis zu 80 % erreicht.
CAD-Systeme (Computer-assisted Detection) können den Radiologen bei der Auswertung der Mammographien unterstützen. Solche Untersuchungen können in den USA und den Niederlanden von den Krankenkassen bezahlt werden. Nach bisher veröffentlichten Studien verbessern die bislang verfügbaren Geräte die Erkennungsrate jedoch nicht. In den europäischen Screeningprogrammen wird daher die Doppelbefundung durch zwei Ärzte (und durch einen dritten bei Auffälligkeiten) bevorzugt.
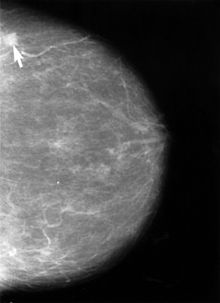
Die Mammographie ist bei Frauen mit dichtem Drüsengewebe in ihrer Aussagekraft begrenzt. Bei extrem dichtem Gewebe werden etwa 50 % der Brusttumoren mit der Mammographie nicht entdeckt. Dies betrifft in erster Linie jüngere Frauen, denen die Sonographie, im Einzelfall auch Kernspin-Mammographie, empfohlen wird. Nach systematischer Literaturrecherche bewertet der IGeL-Monitor (Initiator und Auftraggeber: MDS (Medizinischer Dienst des Spitzenverbandes Bund der Krankenkassen)) die Sonographie (Ultraschall) mit „unklar“, die Magnetresonanztomographie (MRT, Kernspin) mit „tendenziell negativ“. Die Wissenschaftler des IGeL-Monitors fanden in beiden Fällen keine Studien, die die Frage untersucht haben, ob die Untersuchungen Frauen tatsächlich davor bewahren können, an Brustkrebs zu sterben. Das gilt für die Untersuchungen zusätzlich zum Mammographie-Screening ebenso wie als Alternative zum Mammographie-Screening. Bei der MRT sind Schäden durch das Kontrastmittel möglich, das dabei gespritzt wird. Diese Bewertungen gelten für Frauen ab 40 Jahren, die kein erhöhtes Brustkrebs-Risiko haben.
Brust-Computertomographie ist eine alternative Untersuchungsmethode, die sowohl mit als auch ohne Kontrastmittel möglich ist. Die Untersuchung verläuft kompressionsfrei. Da bei der Untersuchung nur der Brust-Bereich umfasst wird, soll nach Bedarf der Bereich der Achseln zusätzlich durch Sonographie untersucht werden. Die Strahlenbelastung liegt etwa im Bereich von der Mammographie.
Früherkennung durch Biomarker (Liquid Biopsy)
Anfang 2019 wurde ein Liquid-Biopsy-Verfahren zur Brustkrebs-Frühdiagnostik durch die Universität Heidelberg veröffentlicht. Inzwischen hat die Staatsanwaltschaft Heidelberg hierzu Vorermittlungen aufgenommen. Uniklinikum und Spin-Off Heiscreen hatten den Test trotz fehlender Daten als „Meilenstein“ in der Brustkrebs-Frühdiagnostik bezeichnet. Finanzielle Verstrickungen von Ärzten, aber auch von Prominenten sollen die PR-Kampagne begünstigt haben.
Auf Basis des innovativen Liquid-Biopsy-Verfahrens sei es möglich, Brustkrebs nicht-invasiv zu diagnostizieren. Das neue Verfahren erkenne eine Krebserkrankung anhand von Biomarkern aus dem Blut. Der Test könne bei Frauen aller Altersgruppen durchgeführt werden; besonders profitieren jüngere Frauen unter 50 Jahren und Frauen mit familiärer Hochrisikosituation für eine Brustkrebserkrankung, bei denen eine Mammographie beispielsweise aufgrund des dichten Brustdrüsengewebes wenig Aussage liefert oder aufgrund anderer Risikofaktoren herkömmliche bildgebende Verfahren kontraindiziert sind. Aktuelle Ergebnisse hätten bei 500 Brustkrebspatientinnen insgesamt eine Sensitivität von 75 Prozent gezeigt. Die Arbeitsgemeinschaft Gynäkologische Onkologie (AGO) der Deutschen Krebsgesellschaft begrüßt ausdrücklich die Forschung zur Liquid-Biopsy-Technologie, warnt aber eindringlich vor einer verfrühten Anwendung des Testes. Eine wissenschaftliche Publikation liege noch nicht vor. Die klinischen Konsequenzen des Testes im Zusammenhang mit den Ergebnissen andere diagnostischer Verfahren, z. B. Mammographie und Sonographie müssen zunächst in Studien überprüft werden.
Diagnose
Bei der Selbstuntersuchung oder bei der ärztlichen, klinischen Untersuchung kann ein neuer, unscharf begrenzter Tumor auffallen. Weitere Anzeichen sind Verhärtungen, Größen- und Umrissveränderungen der Brust im Seitenvergleich, verminderte Bewegung der Brust beim Heben der Arme, bleibende Hautrötung, Hauteinziehung oder Apfelsinenhaut (verdickte Haut mit eingezogenen Stellen), Einziehung oder Entzündung der Brustwarze, Absonderungen aus der Brustwarze. Knoten in der Achselhöhle können Lymphknoten-Metastasen entsprechen. Allgemeinsymptome bei weit fortgeschrittenen Erkrankungen sind u. a. Leistungsknick, ungewollter Gewichtsverlust oder Knochenschmerzen.
Ein lange Zeit unbehandeltes Mammakarzinom oder ein nicht kontrollierbares lokales Tumorrezidiv kann sich lymphangitisch oder subkutan infiltrierend soweit ausdehnen, dass die gesamte Brustwand panzerförmig ummauert erscheint; dieser Zustand wird als Cancer en cuirasse (Panzerkrebs) bezeichnet.
Bildgebende Diagnostik
Werden bei der Tast- oder Ultraschalluntersuchung Auffälligkeiten gefunden, folgt als nächste Untersuchung üblicherweise die Mammographie: Die Röntgenaufnahmen werden aus zwei Blickrichtungen (von der Seite und von oben) gemacht, bestimmte Veränderungen erfordern manchmal zusätzliche Aufnahmen. Die Galaktographie wird nur durchgeführt, wenn die Brustwarzen Sekret absondern. Als Ergänzung steht bei einer solchen Sekretion an einigen Zentren die Duktoskopie, eine Spiegelung der Milchgänge, zur Verfügung.
Umgekehrt werden mit der Mammographie entdeckte Veränderungen immer sonographisch weiter untersucht. Dabei werden gutartige Zysten erkannt. Die Kassenärztliche Bundesvereinigung schrieb 2003 hierfür Schallköpfe mit mindestens 5 MHz Frequenz vor. Mittlerweile ist dieser Wert auf 7,5 MHz erhöht worden.
Die Kernspintomographie der Brust (MR-Mammographie, MRT) wird zurzeit nur empfohlen für das invasive lobuläre Mammakarzinom zur Bestimmung der Resektions-Grenzen und allgemein bei Verdacht auf das Vorliegen mehrerer Tumorherde, gegebenenfalls ist auch eine MRT-gesteuerte Biopsie möglich. Nach brusterhaltender Therapie kann die MRT eingesetzt werden, um zwischen narbigen Verdichtungen in der operierten Brust und neuem Tumorwachstum zu unterscheiden. Außerhalb der ambulanten Versorgung der gesetzlich krankenversicherten Patientinnen gibt es weitere Indikationen.
Die Positronen-Emissions-Tomographie ist derzeit keine Routinemethode, kann jedoch eingesetzt werden, um nach dem Primärtumor bzw. dessen Metastasen zu suchen, wenn dieser mit anderen Methoden nicht gefunden werden kann.
Knochenszintigramme, Computertomographien, Röntgenaufnahmen der Lunge, Sonographien der Leber und ggf. Kernspintomographien dienen dazu, nach Metastasen zu suchen, also die Ausbreitung der Erkrankung zu erkennen. Angesichts der Tatsache, dass die PET/CT bis auf die MRT-Hirn- und Brustuntersuchung genauer ist und zugleich auch andere Krebserkrankungen ausschließen kann, erscheint die PET/CT sinnvoller als Knochenszintigramme, Computertomographien, Röntgenaufnahmen der Lunge und Sonographien der Leber zusammen.
Bei der radiologischen Diagnostik kann zudem ein durch Exsudat entstandener Pleuraerguss, wie er beim Mammakarzinom auftreten kann, zuverlässiger als durch Perkussion erkannt werden.
Gewebeentnahmen
Wurde mit dem Ultraschall und der Mammographie ein Tumor diagnostiziert, wird dieser auf seine Gut- oder Bösartigkeit untersucht. Dazu werden jedem Tumor mittels Stanzbiopsie, in seltenen Fällen mittels Vakuumbiopsie, mehrere Gewebeproben entnommen und unter dem Mikroskop auf Krebszellen untersucht. Methode der Wahl für die Probenentnahme tastbarer und sonografisch sichtbarer Befunde ist die Stanzbiopsie, für im Kernspintomogramm sichtbare Befunde und Mikrokalzifikationen die stereotaktisch gestützte Vakuumbiopsie. Wurde der Tumor als bösartig erkannt, wird das Karzinom durch weitere Untersuchungen des entnommenen Gewebes näher bestimmt. Hierzu gehören der Status der Hormon- und HER2/neu-Rezeptoren sowie der Entartungsgrad.
Nach der Operation wird das aus der Brustdrüse entfernte Operationspräparat in der histologischen Untersuchung auf seine exakte Größe gemessen und das Gewebe auf weiteren Befall untersucht. Die entfernten Lymphknoten werden auf Metastasen geprüft. Die Größe des Karzinoms und die Anzahl der befallenen Lymphknoten sind für die TNM-Klassifikation, Prognose und weitere Behandlung von Bedeutung. Das Operationspräparat wird auch daraufhin vermessen, ob der Abstand zwischen dem Karzinom und dem verbliebenen, gesunden Gewebe ausreichend groß ist. Sollte dies nicht der Fall sein, kann eine Nachoperation nötig werden, damit ein angemessener Sicherheitsabstand zwischen gesundem und erkranktem Gewebe erreicht wird.
Genexpressionstests
Mittlerweile gibt es eine Reihe Genexpressionstests für Patientinnen, die an frühem und hormonrezeptorpositivem Brustkrebs erkrankt sind. Sie untersuchen die Aktivitäten von verschiedenen Genen (Genexpression) in Gewebeproben eines Brustkrebstumors und helfen damit, diejenigen Patientinnen, die von einer adjuvanten Chemotherapie profitieren können und diejenigen Patientinnen, denen diese nebenwirkungsreiche Therapie erspart werden kann, voneinander zu unterscheiden. Die wichtigsten Genexpressionstests für Brustkrebs sind der EndoPredict, Oncotype DX und MammaPrint.
Klassifikation
Die Klassifikation eines Tumors ist dessen exakte Beschreibung auf der Grundlage der pathologischen Untersuchung einer Gewebeprobe oder des OP-Präparats und der entnommenen Lymphknoten.
Histologische Klassifikation
Quelle:
Der häufigste Tumortyp des Mammakarzinoms ist mit etwa 70–80 % ein Adenokarzinom ohne besondere Merkmale; dieser Tumortyp wird als invasives duktales Karzinom (IDC) bezeichnet. Seltener (in etwa 10–15 %) sind das invasive lobuläre Karzinom (ILC), das invasive tubuläre, muzinöse, medulläre, papilläre Karzinom (je etwa 2 %), gemischte und andere Tumortypen. Diese Tumortypen unterscheiden sich in ihrer klinischen Präsentation, den Befunden bei bildgebenden Untersuchungen, dem histologischen Ausbreitungsmuster und in der Prognose. Bei fast allen Tumortypen liegt auch eine nicht invasive (duktale oder lobuläre) Tumorkomponente vor, aus der sie hervorgegangen sind und die für die Größe der Operation mitentscheidend ist. Seltener geht das Mammakarzinom direkt aus gutartigen Erkrankungen hervor (von denen einige bei Mammatumor genannt sind, es handelt sich hier aber nicht um bösartige Tumorerkrankungen).
Als inflammatorisches Mammakarzinom bezeichnet man keinen histologischen Tumortyp, sondern eine sicht- und tastbare Veränderung, nämlich eine Rötung von mindestens einem Drittel der Brusthaut und Schwellung der Brust durch Infiltration der Lymphbahnen. Meist liegt ein lokal fortgeschrittener Befall der Brust und des umgebenden Lymphsystems vor.
Die nicht-invasiven Karzinome sind definiert als Karzinome innerhalb der Brustdrüsengänge (duktales Carcinoma in situ, DCIS) oder -läppchen (lobuläres Carcinoma in situ, LCIS bzw. Lobuläre Neoplasie, LN) ohne Stromainvasion. Eine Sonderstellung nimmt der Morbus Paget der Brustwarze (Mamille) ein, der auf einer nicht-invasiven Tumorausbreitung in die Mamillenhaut beruht und in der Regel mit einem intraduktalen Mammakarzinom, seltener auch mit einem invasiven Mammakarzinom assoziiert ist. Dieses Paget-Karzinom der Brustwarze kann klinisch mit einem Ekzem oder gutartigen Geschwür verwechselt werden.
Differenzierungsgrad
Die histologischen Tumortypen werden anhand struktureller und zellulärer Eigenschaften sowie ihrer Kernteilungsrate unterteilt in drei Differenzierungsgrade (synonym Malignitätsgrad, englisch auch Grading). Die Einstufung des invasiven Karzinoms beruht auf den drei Kriterien Tubulusbildung (Ausbildung röhrenartiger Tumordrüsen), Kernpolymorphie (Vielgestaltigkeit der Zellkerne) und Mitoserate (Teilungsrate der Zellen) nach Elston und Ellis. Je höher das Grading, desto ungünstiger ist das Verhalten der Tumorzellen. Man unterscheidet Tumoren mit Differenzierungsgrad 1, 2 oder 3 (G1 = gut differenziert, G2 = mäßig differenziert, G3 = gering differenziert).
TNM-Klassifikation
Die TNM-Klassifikation beschreibt die Größe des Tumors (T), die Anzahl der befallenen Lymphknoten (N) und eine eventuelle Fernmetastasierung (M). Die tabellierte Kurzfassung der TNM-Klassifikation für Brustkrebs:
|
|
|
||||||||||||||||||||||||||||||||||||||
Stadieneinteilung
Aus der TNM-Klassifikation (bzw. pTNM-Klassifikation, das „p“ steht für histologisch gesicherte Daten) des Mammakarzinoms ergibt sich die Stadiengruppierung nach UICC bzw. AJCC (TNM 6. Auflage. 2003) wie folgt:
| Stadium 0 | Tis | N0 | M0 |
| Stadium I | T1 | N0 | M0 |
| Stadium IIA | T0,T1 | N1 | M0 |
| T2 | N0 | M0 | |
| Stadium IIB | T2 | N1 | M0 |
| T3 | N0 | M0 | |
| Stadium IIIA | T0,T1,T2 | N2 | M0 |
| T3 | N1,N2 | M0 | |
| Stadium IIIB | T4 | N0,N1,N2 | M0 |
| Stadium IIIC | Jedes T | N3 | M0 |
| Stadium IV | Jedes T | Jedes N | M1 |
Hormonrezeptor- und HER2-Status
Der Östrogenrezeptor- und Progesteronrezeptorstatus (ER- und PgR-Expression) wird ebenfalls histologisch, genauer immunhistologisch untersucht. Man bestimmt den Prozentsatz derjenigen Tumorzellen, an denen sich die Rezeptoren nachweisen lassen und errechnet aus Prozentsatz und der Färbeintensität einen 12-stufigen Immunreaktiven Score (IRS), oder den international gebräuchlicheren 8-stufigen Allred-Score.
| Färbeintensität (IS) | Positive Zellen (PP) | ||
|---|---|---|---|
| 0 | keine Reaktion | 0 | keine |
| 1 | schwache Reaktion | 1 | weniger als 10 % |
| 2 | mäßige Reaktion | 2 | zwischen 10 und 50 % |
| 3 | starke Reaktion | 3 | zwischen 51 und 80 % |
| 4 | mehr als 80 % | ||
| IRS | |
|---|---|
| 0–2 | negativ |
| 3–4 | schwach positiv |
| 6–8 | mäßig positiv |
| 9–12 | stark positiv |
Beim HER2-Rezeptor, der für die Entscheidung, ob eine Nachbehandlung mit Trastuzumab (auch in Kombination mit Pertuzumab und Docetaxel) sinnvoll ist, wird ein 4-stufiger Score angewandt, der sich nach der immunhistochemischen Färbeintensität richtet (ASCO-Empfehlung 2007). Lassen sich keine Zellen anfärben, ist das Ergebnis negativ: Score 0. Auch der Score 1+ ist negativ, d. h. eine Behandlung mit Trastuzumab wäre ohne Effekt auf den Tumor. Bei einer mittleren Färbeintensität (Score 2) wird der Tumor mit dem FISH-Test nachuntersucht und anhand Vermehrung (Amplifikation) des HER2-Gens entschieden, ob es sich um einen HER2-positiven Tumor handelt.
| Positive Zellen | Membranfärbung | Färbeintensität | Score |
|---|---|---|---|
| keine | keine | keine | 0 |
| 1 % oder mehr | nicht komplett | schwach | 1+ |
| weniger als 10 % | vollständig | schwach bis mäßig | 1+ |
| 10 % oder mehr | vollständig | schwach bis mäßig | 2+ |
| 30 % oder weniger | vollständig | stark | 2+ |
| mehr als 30 % | vollständig | stark | 3+ |
Risikogruppen, Einteilung nach Ergebnissen der Konsensuskonferenzen in St. Gallen
Die alle zwei Jahre in St. Gallen abgehaltene Konsensuskonferenz beschäftigt sich vor allem mit der adjuvanten Therapie. Um die Chemo- und Hormontherapie möglichst zielgerecht einsetzen zu können, werden der Empfehlung von 2007 folgend die operierten Patientinnen in drei Risiko-, besser Behandlungsgruppen eingeteilt:
| Niedriges Risiko | Mittleres Risiko | Hohes Risiko | |
|---|---|---|---|
| Anzahl der befallenen Lymphknoten: |
keiner und alle folgenden Kriterien: | 1 bis 3 oder keiner, aber mindestens ein weiteres Kriterium: |
mehr als 4 oder 1 bis 3 und |
| Tumorgröße: | T1 (max. 2 cm) | T2 bis T4 (größer als 2 cm) | |
| Differenzierung: | G1 | G2 und G3 | |
| Tumoreinbruch: | Invasion in Gefäße | ||
| Hormonstatus: | ER/PR-positiv (Östrogen-/Progesteron-positiv) | ||
| HER2/neu-Status: | HER2/neu-negativ | HER2/neu-positiv | HER2/neu-positiv |
| Alter: | 35 Jahre und älter | oder jünger als 35 Jahre |
Molekulare Tumorklassifikation
Anhand des Genexpressionsprofils, welches mit DNA-Microarrays aus dem Tumorgewebe gewonnen werden kann, kann man fünf verschiedene Hauptgruppen des Mammakarzinoms unterscheiden: Hormonrezeptorpositive Tumoren mit geringer bzw. höherer Aggressivität (genannt Luminal-A und Luminal-B, von lumen = Hohlraum der Milchgänge), HER2-positive Tumoren (erbB2-Phänotyp) und Hormonrezeptor- und HER2-negative Karzinome mit oder ohne Basalzell-Eigenschaften (basal-like und normal-like Phänotypen). Die zurzeit noch experimentelle molekulare Tumorklassifikation könnte in Zukunft eine bessere Abschätzung der Prognose und der voraussichtlichen Wirkung der adjuvanten Hormon- und Chemotherapie ermöglichen.
Genexpressionsanalysen
Eine zentrale Frage bei der Behandlung des operablen Mammakarzinoms ist die Frage, wie hoch das Risiko eines Wiederauftretens der Erkrankung (Rezidivrisiko) ist. Patientinnen mit hohem Rezidivrisiko sollten eine adjuvante Chemotherapie erhalten, während Patientinnen mit niedrigem Risiko die nebenwirkungsreiche Chemotherapie erspart bleiben sollte. Die in der Vergangenheit gehandhabte, auf rein klinischen Faktoren wie Tumorgröße, Menopausestatus, Alter etc. beruhende Abschätzung des Rezidivrisikos hat sich als ungenau erwiesen. Einige Patientinnen, die als „Niedrigrisiko“ klassifiziert wurden, erleiden trotzdem ein Rezidiv. Andererseits wird davon ausgegangen, dass viele Chemotherapien überflüssigerweise gegeben werden, d. h. viele Patientinnen wären auch ohne eine solche geheilt.
Um eine genauere Vorhersage des Rezidivrisikos zu ermöglichen, wurden sogenannte Gensignaturen entwickelt, mit dem Ziel, das Risiko eines Wiederauftretens der Erkrankung genauer vorherzusagen. Dabei wird die Genexpression einer Reihe von Genen im Tumorgewebe gemessen und ein Punktwert (Risikoscore) berechnet, der das Risiko eines Rezidivs anzeigen soll. Ab einem gewissen Punktwert wird dann die Chemotherapie empfohlen.
Im Juli 2019 waren vier kommerzielle Genexpressionstests erhältlich. Alle vier Tests waren in klinischen Studien für Mammakarzinome im Frühstadium evaluiert worden.
|
Oncotype DX (Genomic Health) |
Mammaprint (Agendia) |
EndoPredict (Myriad) |
ProSigna (Nanostring) |
|
|---|---|---|---|---|
| Zahl der Gene | 21 | 70 | 11 | 50 |
| Tumor | HR+, HER2- | HR+/-, HER2- | HR+, HER2- | HR+, HER2- |
| Menopausestatus | prä und post | prä und post | prä und post | nur post |
| Nodalstatus | N0 | N0, N+ | N0, N+ | N0, N+ |
| Evidenz | TAILORx-Studie (9 Jahre prospektiv) |
MINDACT-Studie (5 Jahre prospektiv) |
prospektiv-retrospektive Daten aus verschiedenen Studien | prospektiv-retrospektive Daten aus verschiedenen Studien |
Nach einer Entscheidung des Gemeinsamen Bundesausschusses (GBA) vom 20. Juni 2019 sollen die Kosten des Genexpressionstests Oncotype DX künftig durch die gesetzlichen Krankenkassen erstattet werden (Regelleistung).
Therapie
Zur Vereinheitlichung und Verbesserung der Krankenversorgung gibt es in Deutschland seit 2003 im Auftrag der Deutschen Krebsgesellschaft und der Deutschen Gesellschaft für Senologie von OnkoZert zertifizierte Brustzentren an Krankenhäusern und seit 2004 ein Disease-Management-Programm für Brustkrebs, an dem sich auch niedergelassene Ärzte beteiligen können. Die gemeinsame Leitlinie der Stufe S3 der Deutschen Krebsgesellschaft und der medizinischen Fachgesellschaften ist für diese Programme die Orientierung zur Behandlung von Brustkrebs. Diese Leitlinie wird regelmäßig aktualisiert, zuletzt im Februar 2020.
Die Strategie zur Brustkrebsbehandlung wird meist im Rahmen einer Tumorkonferenz geplant, an der sich Gynäkologen, internistische Onkologen, Radiologen, Strahlentherapeuten und Pathologen beteiligen. Die Einbindung der Patientin in die Entscheidungsfindung ist wie bei jeder eingreifenden medizinischen Maßnahme von großer Bedeutung (siehe informierte Einwilligung). Auch der deutsche Gesetzgeber spricht in der DMP-Richtlinie deutlich vom Status der aufgeklärten Patientin.
Die Therapie der Brustkrebserkrankung soll im Frühstadium eine Heilung, beim metastasierten Karzinom eine Lebenszeitverlängerung und im Spätstadium eine Linderung der Krankheitsbeschwerden erreichen. Bei der Wahl der konkreten Therapie steht die Erhaltung der Lebensqualität im Vordergrund. Darum wird neben den weiter oben beschriebenen Klassifikationen des Tumors auch die körperliche, psychosoziale und emotionale Situation der Patientin berücksichtigt. Eine „Standardtherapie“ gibt es nicht, die Berücksichtigung aller verschiedenen Faktoren führt zu einer individuellen Anpassung der Therapie an die Krankheit und an die jeweilige Patientin.
Brustkrebs kann sich sehr schnell im Körper ausbreiten und wird daher schon in frühen Stadien mit einer systemischen (im ganzen Körper wirksamen) Therapie behandelt. Diese nach dem amerikanischen Chirurgen Bernard Fisher benannte „Fisher-Doktrin“ ist die Grundlage der Chemo- und Hormontherapie beim Brustkrebs. Fast immer besteht die Behandlung heute aus einer Kombination verschiedener Therapieformen. Werden zusätzliche Maßnahmen vor einer Operation durchgeführt, werden sie als neoadjuvant bezeichnet, werden sie nach einer Operation eingesetzt, nennt man sie adjuvant.
Neoadjuvante Therapie
In einigen Fällen wird eine Chemotherapie oder antihormonelle Therapie schon vor der chirurgischen Entfernung des Tumors durchgeführt. Diese primäre, oder neoadjuvante Therapie hat einerseits das Ziel, den Tumor zu verkleinern, um eine vollständige Entfernung des Tumors oder sogar eine brusterhaltende Operation zu ermöglichen, andererseits kann an der mit den neoadjuvanten Verfahren erreichbaren Veränderung der Erfolg einer weiteren, adjuvanten Behandlung abgeschätzt werden. Standard ist die neoadjuvante Therapie beim inflammatorischen Karzinom und bei zunächst inoperablen (T4-)Tumoren. Die Chemotherapieschemata sind die gleichen wie bei der postoperativen Behandlung (siehe unten).
Operation
Mit der Operation der Brustkrebserkrankung werden zwei Ziele verfolgt: Einerseits soll durch möglichst vollständige Entfernung der entarteten Zellen eine Ausbreitung (Metastasierung) der Tumorzellen in andere Körperregionen verhindert werden, sofern das noch nicht geschehen ist, andererseits soll ein Wiederauftreten der Krankheitszeichen an Ort und Stelle (ein Rezidiv) verhindert werden.
Brusterhaltende Chirurgie vs. Mastektomie


Eine brusterhaltende Therapie (BET) ist heute bei 60–70 % der Erkrankten möglich, wenn die Relation zwischen der Tumorgröße und dem Brustvolumen günstig und der Tumor noch nicht in die Muskulatur oder Haut eingedrungen ist. Bei dieser Operation wird entweder der Tumor mit dem umliegenden Gewebe (Lumpektomie), ein größeres Segment oder ein ganzer Quadrant (Quadrantektomie) entfernt. Um ein kosmetisch ansprechendes Ergebnis zu erhalten, wird bei größerer Gewebeentfernung vor allem aus beiden unteren Quadranten eine sogenannte intramammäre Verschiebeplastik vorgenommen. Dabei wird die Brustdrüse ganz oder teilweise von Haut und Muskulatur gelöst und so verschoben, dass nach der Operation trotz des Gewebeverlustes eine ausgeglichene Brustform erhalten bleibt. Ist eine Verschiebeplastik nicht möglich, kann die Brust entweder direkt nach der Tumorentfernung oder nach Abschluss aller Behandlungen rekonstruiert werden.
Sollte eine Brusterhaltung nicht möglich sein, wird der gesamte Brustdrüsenkörper und ein Teil der darüber liegenden Haut entfernt (Ablatio, Mastektomie). Die Empfehlung zur Mastektomie wird ausgesprochen, wenn:
- der Tumor sehr groß ist (> 3 cm) oder den Brustmuskel infiltriert hat,
- ein inflammatorisches Karzinom diagnostiziert wurde,
- ein ausgedehnter Befall der Lymphgefäße der Brustdrüse nachgewiesen wurde,
- der Tumor ausgedehnte „Arme“ in die Milchgänge gebildet hat (Duktales in situ Karzinom),
- die gesamte Brustdrüse eine durch die Mammographie nachgewiesene Mikroverkalkung enthält,
- der Tumor trotz Nachoperation nicht mit einem ausreichenden Sicherheitsabstand zum gesunden Gewebe entfernt werden konnte,
- die Patientin dies wünscht. Manche Patientinnen entscheiden sich gegen die Möglichkeit zur brusterhaltenden Operation, um sich sicherer zu fühlen oder um die sonst notwendige Strahlentherapie zu vermeiden.
Die Empfehlung zur Mastektomie wird auch ausgesprochen, wenn ein multizentrisches (Tumorknoten in mehreren Quadranten) oder multifokales (mehrere Tumorknoten im selben Quadranten) Karzinom diagnostiziert wurde. Diese Empfehlung kann manchmal relativiert werden, wenn der Operateur alle Tumoren mit einem ausreichenden Sicherheitsabstand zum gesunden Gewebe entfernen kann. Auch wenn eine Krebserkrankung schon in andere Organe metastasiert hat, kann der ursprüngliche Tumor schonender operiert werden, wenn das radikale chirurgische Vorgehen keinen Vorteil bringen würde.
Für die Versorgung von Frauen sowohl nach Brustamputation als auch nach brusterhaltender Operation (Chirurgie) oder auch nach Wiederaufbau mit unzureichendem kosmetischem Ergebnis werden Brustprothesen und Brustausgleichsteile aus Silikon eingesetzt. Frauen nach einer Brustoperation haben in der Regel Anspruch auf die Versorgung mit einer Brustprothese (auch Brustepithese genannt) bzw. einem Brustausgleichsteil, deren Kosten inkl. Beratung und Anpassung dann als medizinisches Hilfsmittel von den Krankenkassen übernommen wird. Als Halterung für die Prothese gibt es spezielle Prothesen-BHs und Prothesen-Badeanzüge mit eingearbeiteten Taschen, die zusammen mit dem Brustausgleich im Sanitätsfachgeschäft erhältlich sind.
Achsellymphknoten
Die Lymphknoten der Achsel sind meist der erste Ort, an dem sich Metastasen bilden. Um diesen Befall zu erfassen, werden die Lymphknoten, zumindest einige von ihnen, bei der Operation oft mit entfernt.
Um die Folgeschäden (Lymphödem) so gering wie möglich zu halten, kann zunächst nur ein einzelner Lymphknoten entfernt und untersucht werden, wenn der Tumor in der Brust kleiner als 2 cm ist und die Achsellymphknoten nicht tastbar sind. Dazu wird in die betreffende Brust ein Farbstoff oder ein Radionuklid injiziert, um den Lymphabfluss darzustellen. Der erste Lymphknoten, in dem das eingespritzte Material nachgewiesen werden kann, wird herausoperiert und untersucht. Nur wenn dieser sogenannte Wächterlymphknoten (sentinel node) von Tumorzellen befallen ist, werden weitere Lymphknoten der Achselhöhle ebenfalls entfernt (teilweise oder komplette Axilladissektion).
Nicht-invasive Tumorzerstörung
2013 wurde in Rom erstmals ein Verfahren getestet, bei dem noninvasiv mittels Ultraschallwellen bei einer ambulanten Behandlung Tumorgewebe zerstört werden kann. Bei der anschließenden Operation konnten bei 10 von 12 Patientinnen mit Tumoren kleiner als 2 cm keine Tumorreste mehr gefunden werden. Das Verfahren muss jedoch weiterhin getestet und optimiert werden.
Adjuvante Therapie
Fast alle Patientinnen erhalten nach der Operation eine adjuvante (unterstützende) Behandlung.
Chemotherapie
Nach der Operation folgt für viele Patientinnen mit höherem Rückfallrisiko eine Chemotherapie, um möglicherweise verbliebene Tumorzellen abzutöten. Die Notwendigkeit der Chemotherapie wird anhand des Tumortyps, des Stadiums und anderer Faktoren beurteilt. Wenn der Tumor hormonabhängig, kleiner als 2 cm und die Lymphknoten frei von Metastasen sind, kann in den meisten Fällen auf eine Chemotherapie verzichtet werden. Bei dieser Konstellation können mit einer antihormonellen Therapie ähnliche Ergebnisse erzielt werden (St. Gallen 2007).
Welche Chemotherapie verabreicht wird, hängt vom Zustand der Patientin und von der Klassifikation des Tumors ab, vor allem von der Risikogruppe nach der St.-Gallen-Empfehlung. Die Behandlung wird in mehreren Zyklen durchgeführt, beispielsweise insgesamt viermal im Abstand von drei Wochen oder sechsmal in Abstand von zwei Wochen. Der Zeitabstand zwischen den einzelnen Gaben soll dem Körper einerseits die Gelegenheit zur Regeneration geben, andererseits hofft man darauf, dass Mikrometastasen (ruhende Tumorzellen) bzw. Krebsstammzellen in den Erholungsphasen mit der Teilung beginnen und mit der erneuten Zuführung der Zytostatika zerstört werden können.
In der Regel werden die Zytostatika als Kombinationen eingesetzt. Die häufigsten Schemata sind zurzeit AC oder EC, FAC oder FEC. Wenn die Lymphknoten mit Metastasen befallen waren, wird eine Ergänzung der jeweiligen Kombination mit Taxanen (Paclitaxel und Docetaxel) empfohlen (St. Gallen, 2007). Das ältere CMF-Schema wird kaum noch verwendet. (A = Adriamycin, C = Cyclophosphamid, E = Epirubicin, F = Fluoruracil, M = Methotrexat, T = Taxane) Inzwischen werden Chemotherapien auch mit weiteren Therapien wie der zielgerichteten Antiangiogenese („Therapie des metastasierten Mammakarzinoms“, siehe unten) erfolgreich kombiniert.
Seit dem Juli 2019 werden durch die gesetzlichen Krankenkassen auch die Kosten eines Genexpressionstests übernommen, mit dem die Frage beantwortet werden kann, ob eine adjuvante Chemotherapie im Frühstadium eines operierten Mammakarzinoms erforderlich ist (→ Genexpressionsanalysen).
HER2/neu positive Tumoren
Um das Risiko eines erneuten Auftretens der Erkrankung (Rezidiv) zu senken, wird bei HER2/neu positiven Tumoren in der Regel im Anschluss an die Chemotherapie ein Jahr lang die Behandlung mit dem HER2-Antikörper Trastuzumab durchgeführt („Antikörper-Therapie“, siehe unten), seltener auch ohne vorherige Chemotherapie. Die Dauer und die Zusammensetzung der Chemotherapie wird vom Ausmaß der befallenen Lymphknoten mitbestimmt (St. Gallen 2007). Nach einer Trastuzumab Behandlung kann Neratinib für den gleichen Zweck eingesetzt werden.
Bestrahlung
Nach der brusterhaltenden Operation sollte eine Strahlentherapie der Brust erfolgen. Sie senkt die Rezidivrate von 30 auf unter 5 %. Mikroskopisch kleine (nicht mit bloßem Auge erkennbare) Tumorreste können auch bei sorgfältigster Operation in der Brustdrüse verbleiben.
Auch nach einer Mastektomie wird zur Nachbestrahlung geraten, wenn der Tumor größer als 5 cm war (T3 oder T4), die Brustdrüse mehrere Tumoren enthielt oder der Tumor bereits in Haut oder Muskulatur eingedrungen war. Auch der Befall von Lymphknoten ist ein Anlass zur Nachbestrahlung der Brustwand, insbesondere bei mehr als drei befallenen Lymphknoten.
Das ehemalige Tumorgebiet soll bei Frauen unter 60 Jahren mit einer um 10–16 Gy höheren Dosis bestrahlt werden, damit sich an den Schnitträndern keine Rezidive ausbilden können.
Die Strahlentherapie beginnt zirka 4–6 Wochen nach der Operation und dauert sechs bis acht Wochen. Eine befürchtete Erhöhung koronarer Ereignisse als Langzeitfolge der Strahlenwirkung auf das Herz konnte nicht bestätigt werden, es gibt eine gewisse Risikoerhöhung, das absolute Risiko ist jedoch sehr gering und kann durch moderne Strahlentherapie eventuell weiter gesenkt werden.
Antihormonelle Therapie
Ist das Karzinom hormonsensitiv, wird zusätzlich eine Therapie mit Hormonantagonisten durchgeführt. Es gibt verschiedene, vom menopausalen Status der Frau und dem genauen Tumortyp abhängige Varianten.
Vor der Menopause
Ende des 19. Jahrhunderts wurde ein möglicher Zusammenhang zwischen Brustkrebs und der Ovarialfunktion erkannt. Dies veranlasste Beatson 1895 eine „therapeutische Kastration“ vorzunehmen. Eine chirurgische Ovariektomie oder radiotherapeutische Ausschaltung der Ovarfunktion wird nur noch selten vorgenommen. Studien zufolge genügt eine temporäre Ausschaltung der Hormonproduktion über zwei Jahre, die medikamentös erreicht werden kann.
Bei Frauen, die noch die Periode haben, wird schon durch Chemotherapie die Hormonfunktion der Eierstöcke gestört. Dieser Effekt richtet sich auch gegen die hormonabhängigen Tumorzellen und ist daher erwünscht. Frauen mit Kinderwunsch oder Frauen, denen das Risiko einer vorzeitigen Menopause zu groß ist, können ihre Eierstöcke mit GnRH-Analoga (die die ovariale Produktion von Östrogen und Progesteron unterdrücken) vor der schädigenden Wirkung schützen und gleichzeitig die Hormonausschaltung bewirken. GnRH-Analoga werden in der Regel über zwei Jahre gegeben.
Nach der Chemotherapie wird normalerweise ein Estrogen-Rezeptor-Modulator wie Tamoxifen, welcher die Anbindung des körpereigenen Östrogens an den Östrogen-Rezeptoren des Tumors verhindert, für 5 Jahre gegeben.Aromatasehemmer sind vor der Menopause nicht angezeigt.
Nach der Menopause
Ist die Patientin postmenopausal, erhält sie für in der Regel fünf Jahre entweder Tamoxifen oder einen Aromatasehemmer, welcher durch eine Enzymblockade die Bildung von Östrogen im Muskel- und Fettgewebe unterbindet. Neuere Studienergebnisse deuten an, dass die Aromatasehemmer wirksamer sind als das Tamoxifen, das heißt, die krankheitsfreie Überlebenszeit steigt an. In Studien wird der Aromatasehemmer manchmal sofort verwendet (upfront), in der Regelbehandlung erst nach zwei bis drei Jahren unter Tamoxifen (switch, dt. ‚Wechsel‘), oder nach fünf Jahren (extended). Die jeweiligen Nebenwirkungen der Substanzen müssen bei der Entscheidung berücksichtigt werden. Auf Grund der besseren Wirksamkeit sind Aromatasehemmer zu Therapiebeginn erste Wahl und werden entsprechend häufiger verordnet. Tamoxifen wird dagegen seit 2003 immer seltener verschrieben. Eine weitere Möglichkeit besteht in der Gabe eines reinen Estrogen-Rezeptor-Antagonisten (Fulvestrant; Handelsname Faslodex), der von den Arzneimittelbehörden jedoch bisher nur bei fortgeschrittenem Brustkrebs zugelassen ist.
Bei vielen Patientinnen mit hormonabhängigen Tumoren verliert Tamoxifen nach einigen Jahren seine Schutzwirkung (sogenannte Tamoxifenresistenz). Laborversuchen zufolge kann im Gegenteil sogar eine Beschleunigung des Zellwachstums eintreten. Betreffende Frauen sollten besser mit anderen Substanzen behandelt werden. Es ist bislang aber noch nicht möglich, das Verhalten eines individuellen Tumors in dieser Beziehung vorauszusagen. Ein Hinweis könnte das gleichzeitige Auftreten einer HER2/neu- und AIB1-Expression an einem ER-positiven Tumor sein.
Androgenrezeptorabhängige Tumortypen
Die meisten Mamma-Karzinome besitzen auch Rezeptoren für das männliche Geschlechtshormon Testosteron und andere Androgene Hormone. Bei ER+ Tumortypen wird der Anteil der AR+ Tumoren mit über 80 % angegeben, bei den „dreifach-negativen“ Tumortypen (Triple-negative breast cancer, TNBC) wird der Anteil mit etwa 10–50 % geschätzt.
Abhängig vom Estrogenrezeptorstatus kann Testosteron eine wachstumshemmende Wirkung bei ER+ Tumoren oder eine wachstumstreibende Wirkung bei ER-/PR-Tumortypen entfalten. Der Androgenrezeptor reagiert teilweise auch mit anderen Androgenhormonen und Progestinen.
Speziell für AR+/ER-/PR-Tumortypen in lokal fortgeschrittenem oder metastasiertem Stadium wurde zwischen 2007 und 2012 die Behandlung mit dem Antiandrogen Bicalutamid in einer Phase II Studie mit gutem Erfolg erprobt.
Da der Patentschutz von Bicalutamid (Casodex) ausgelaufen ist, wird inzwischen das neuere Enzalutamid für diesen Einsatzbereich getestet, bis jetzt sind jedoch nur in vitro Experimente bekannt.
Historisch belegt ist ferner der Einsatz von Testosteron bei ER+ Tumortypen, die erzielten Ergebnisse waren in etwa vergleichbar mit Tamoxifen, jedoch mit stärkeren Nebenwirkungen verbunden. Ein ähnlicher Wirkungsmechanismus wird teilweise bei der experimentellen Behandlung mit Progestinen vermutet.
Antikörper
Etwa ein Viertel aller Mammakarzinome weisen eine Überexpression des HER2/neu-Rezeptors auf. Der Nachweis dieses Rezeptors steht für einen aggressiven Krankheitsverlauf und eine ungünstige Prognose, ist aber auch Bedingung für die Behandlung (Krebsimmuntherapie) mit dem Antikörper Trastuzumab. Neben der alleinigen Verabreichung von Trastuzumab wird dieser auch in Kombination mit dem monoklonalen Antikörper Pertuzumab und dem Zytostatikum Docetaxel eingesetzt.
1998 wurde der Wirkstoff (Handelsname: Herceptin) in den USA und 2000 in der Europäischen Union zunächst für Patientinnen mit metastasiertem Brustkrebs zugelassen. Trastuzumab ist ein monoklonaler Antikörper gegen den Wachstumsrezeptor HER2/neu auf der Zelloberfläche von Krebszellen. Studien ergaben, dass mit dieser sogenannten gezielten Krebstherapie (targeted therapy) das Risiko eines Rezidivs (Wiederauftretens) um etwa 50 % gemindert werden konnte. Viele klinische Studien zeigen, dass auch Frauen ohne Metastasen profitieren. Die HER2-Antikörpertherapie kann Rückfälle verhindern und so zur Heilung beitragen. Seit 2006 ist Trastuzumab deshalb auch für die adjuvante Therapie zugelassen.
Therapie des metastasierten Mammakarzinoms
Fernmetastasen verschlechtern die Prognose rapide, da in der Regel bei Vorliegen einer sichtbaren Fernmetastase multiple Mikrometastasen vorhanden sind. Deshalb richtet sich die Behandlung auf die Lebenszeitverlängerung und den Erhalt einer angemessenen Lebensqualität mit einer langfristigen Stabilisierung der körperlichen und psychischen Verfassung. Brustkrebs bildet ausgesprochen häufig Knochenmetastasen.
Rezidive und Metastasen können operativ entfernt oder mit Strahlentherapie behandelt werden. Trotz der Nebenwirkungen kann unter Umständen auch mit der Verabreichung einer Chemo-, Hormon- oder durch eine gezielte Krebstherapie eine Erhöhung der Lebensqualität und eine Verlängerung der Zeit bis zum Fortschreiten der Erkrankung (Progressionsfreies Überleben) erreicht werden. Das zur Gruppe der Taxane gehörende Paclitaxel-Albumin (Handelsname: Abraxane) ist – in Monotherapie – indiziert für die Behandlung von metastasierendem Mammakarzinom bei erwachsenen Patienten, bei denen die Erstlinientherapie für metastasierende Krankheit fehlgeschlagen ist und für die eine standardmäßige Anthracyclin-enthaltende Therapie nicht angezeigt ist.
Zusätzlich zu den bei der adjuvanten Therapie eingesetzten Wirkstoffen kommt beim HER2/neu-positiven metastasierten Mammakarzinom auch der Tyrosinkinase-Inhibitor Lapatinib zum Einsatz. Metastasierte HER2/neu-negative Tumoren können seit 2007 mit dem Angiogenese-Hemmer Bevacizumab behandelt werden. Diese gezielte Krebstherapie kann in Kombination mit einer Chemotherapie aus Paclitaxel oder Docetaxel angewendet werden. Studien zu weiteren Kombinationsmöglichkeiten laufen zurzeit. Durch die Antiangiogenese wird die vom Tumor ausgelöste Neubildung von Blutgefäßen verhindert. Infolgedessen wird der Tumor nicht mehr ausreichend versorgt und die Tumorzellen sollen dadurch zugrunde gehen.
Eribulin (Handelsname: Halaven) ist ein nichttaxanbasiertes, hochwirksames neues Zytostatikum (Zulassung in den USA im November 2010; in Europa im März 2011), das in Monotherapie für die Therapie von stark vorbehandelten Patientinnen mit lokal fortgeschrittenem oder metastasiertem Brustkrebs eingesetzt wird.
Wenn der Krebs in seiner Ausbreitung so weit fortgeschritten ist, dass er nicht mehr zurückgedrängt werden kann, richtet sich die Behandlung vor allem auf die Beherrschung von Schmerzen und anderen Krankheitsbeschwerden. Zur Palliativmedizin gehört die psychosoziale Betreuung und eine Schmerzbehandlung, die schnell und vollständig erfolgen sollte und eine frühzeitige und ausreichende Gabe von Opiaten einschließt, siehe WHO-Stufenschema.
Nachsorge
Die Nachsorge der behandelten Patienten dauert in der Regel fünf Jahre und richtet sich zumeist nach den Leitlinien der Deutschen Krebsgesellschaft. Auf Nebenwirkungen der Strahlentherapie (Lymphödem, Lungen- oder Herzprobleme), der Chemotherapie (Blutbildveränderungen, Organschäden) und der Hormontherapie (Thrombosen, Osteoporose) muss besonders geachtet werden. Neben der Befragung und klinischen Untersuchung soll in den ersten drei Jahren, da hier die meisten Rezidive auftreten, alle sechs Monate eine Mammographie angefertigt werden. Ab dem vierten Jahr erfolgt die Mammographie – ebenso wie bei der zweiten, gesunden Brust von Anfang an – jährlich. Gemäß S3-Leitlinie kehrt die Patientin nicht mehr zu einem zweijährigen Intervall oder in das Screening Programm zurück. Zur Verlaufskontrolle können in der Blutuntersuchung die Tumormarker CA 15-3 und CEA bestimmt werden, was allerdings nicht in den Richtlinien vorgesehen ist und meistens eher bei konkretem Verdacht der Fall ist. Es muss bei jeder einzelnen Patientin sehr sorgfältig abgewogen werden, ob die Nachsorge in der hier angegebenen Form tatsächlich durchgeführt werden soll; jede kleine nachgewiesene Veränderung kann eine erhebliche psychische Belastung nach sich ziehen, die wiederum die Lebensqualität entscheidend beeinflussen kann.
Hilfreich, als begleitende Heilmethode, für die Rehabilitation nach einer Brustkrebserkrankung und anschließender erfolgreicher Behandlung, ist zudem körperliche Aktivität.
Für eine einheitliche Qualität bei der Nachbetreuung bieten die deutschen gesetzlichen Krankenkassen seit 2004 das Disease-Management-Programm „Brustkrebs“ an. Die teilnehmenden Ärzte orientieren sich bei der Therapie an den jeweils aktuellen Leitlinien zur Behandlung und Nachsorge des Brustkrebses. Eine Teilnahme ist bei allen Ärzten möglich, die sich diesen qualitätssichernden Programmen angeschlossen haben. Für die Patientinnen bedeutet die Teilnahme an diesem Programm eine Einschränkung der freien Arztwahl.
Geschichte
Entzündliche Brustleiden wie Abszesse wurden bereits in frühester Zeit mit dem Messer gespalten. Die ersten Dokumentationen von Brustkrebserkrankungen stammen aus der Zeit von 2650 v. Chr. aus dem Alten Ägypten. Zu dieser Zeit wurden sie mit einem Brenneisen behandelt. Im Papyrus Edwin Smith (um 1600 v. Chr.) wurden acht Brustkrebserkrankungen beschrieben, auch die eines Mannes, welche ebenfalls durch Kauterisation behandelt wurden. Der Papyrus Ebers enthält eine Beschreibung von Brustkrebs. Die Krebserkrankungen der Brust galten zur damaligen Zeit als nicht heilbar.
Auch im Corpus Hippocraticum wurde der Fall eines Mammakarzinoms geschildert. Von einer chirurgischen Behandlung tiefliegender Tumorerkrankungen wurde dort abgeraten, da nicht operierte Patienten länger lebten.
Der griechische Arzt Galen sah Brustkrebs als Folge einer Säftestörung und damit als systemische Erkrankung, eine Krankheit des ganzen Organismus, an. Als Mittel zur Behandlung wurden bis in das Mittelalter unterschiedlichste Rezepturen genutzt, um den als Ursache angesehenen eingedickten Körpersaft „Galle“ zu verflüssigen und abzuführen. Bestandteile waren, unter anderem, Blei- und Zinkkarbonat, Rosenöl und Hirschkot. Die im Mittelalter durchgeführten Ätztherapien bei Carcinoma mammae oder dafür gehaltenen Brusterkrankungen wurden auch im 19. Jahrhundert noch durchgeführt, etwa mit Arsenik, Jod, Quecksilberpräpataten, Chlorzink und Chlorkalipräparaten.
Die erste Operation bei Brustkrebs soll Leonidas aus Alexandria um 100 n. Chr. durchgeführt haben. Zur Blutstillung und Entfernung von Tumorresten nutzte er ein Brenneisen.Andreas Vesalius empfahl um 1543 bei Brustkrebs eine Entfernung der Brust (Mastektomie), bei welcher er jedoch eine Blutstillung mit Nähten der Kauterisation vorzog.
Der französische Chirurg Jean-Louis Petit (1674–1750) legte das erste Konzept zur operativen Behandlung von Brustkrebs vor, welches jedoch erst 24 Jahre nach seinem Tode veröffentlicht wurde. Sein Kollege Henry François Le Dran (1685–1770) meinte 1757, dass der Brustkrebs zumindest am Anfang lokaler Natur wäre. Erst wenn er sich seinen Weg in die Lymphbahnen geschaffen habe, sei die Prognose für die Patientin schlecht. Er entfernte daher die komplette Brust mitsamt den Lymphknoten der Achselhöhle. Auch der schottische Chirurg Benjamin Bell (1749–1806) erkannte die Bedeutung einer Entfernung der Lymphknoten aus der Achselhöhle.
Rudolf Virchow (1821–1902) konnte 1840 nachweisen, dass sich die Erkrankung aus den Epithelzellen entwickelt und sich entlang der Faszien und Lymphbahnen ausbreitet. Damit wandelte sich die Sicht vom Brustkrebs, welcher jetzt eher als lokale Erkrankung betrachtet wurde.
Im Jahr 1867 stellte Charles H. Moore fest, dass die Ursache für ein Krebsrezidiv die unvollständige Entfernung des Primärtumors ist, und forderte daher bei Brustkrebs das benachbarte Gewebe (Haut, Lymphknoten, Fett, Pectoralismuskel) mitzuentfernen. Richard von Volkmann entfernte 1875 dementsprechend die Pectoralisfaszie mit.
Diesem Konzept folgte auch William Stewart Halsted (1852–1922), der 1882 die erste radikale Mastektomie mit Entfernung der Faszie, der Brustmuskeln (Musculus pectoralis major, später auch in Anlehnung an eine von Willy Mayer vor der New Yorker Medizinischen Akademie vorgetragenen Methode den Musculus pectoralis minor) und der Achsellymphknoten durchführte. Für die damaligen Verhältnisse konnte damit eine lokale Tumorkontrolle mit einer 5-Jahres-Lokalrezidivrate von sechs Prozent erreicht werden. Im deutschsprachigen Raum war Josef Rotter (1857–1924) Vorreiter dieser zum Standard gewordenen Methode, die er ab 1889 bei seinen Patientinnen durchführte.
1874 beschrieb der englische Chirurg James Paget (1814–1899) eine ekzemartige Veränderung der Brustwarze mit angrenzendem duktalen Adenokarzinom, welche später als Morbus Paget bezeichnet wurde.
Bis etwa 1884 glaubten manche Ärzte, dass Brustkrebs durch eine „Impfung“ mit Erysipelerregern erfolgreich behandelt werden könne.Albert Schinzinger empfahl 1889 zur Behandlung inoperabler Mammakarzinom die Kastration. Der schottische Chirurg George Thomas Beatson erkannte 1895, dass die Entfernung der Eierstöcke bei einer seiner Patientinnen den Brusttumor schrumpfen ließ. 1897 wurde Brustkrebs erstmals bestrahlt. Nachdem Hormone auch synthetisch hergestellt werden können, wurden auch endokrine Therapien vermehrt eingesetzt. Im Jahr 1927 wurde in Deutschland über die erste brusterhaltende Operation beim Mammakarzinom berichtet.
1948 veröffentlichten David H. Patey und W. H. Dyson eine etwas weniger radikale Operationsmethode als Rotter und Halsted mit gleich guten Ergebnissen, bei welcher die Brustmuskeln erhalten bleiben konnten. Sie wird heute noch als modifiziert-radikale Mastektomie nach Patey bezeichnet. Ein weiterer Rückgang der operativen Radikalität begann mit Robert McWhirter, der 1948 nach einfacher Mastektomie eine Strahlentherapie durchführte. Einige Jahre nach der Entdeckung der Röntgenstrahlen wurden diese ab etwa 1900 auch zur Behandlung, von Brustkrebs eingesetzt, insbesondere zur (neoadjuvanten bzw. adjuvanten) Vor- oder Nachbestrahlung.
Mit den Arbeiten von Bernhard und E. R. Fisher setzte sich in den 1960er Jahren die Auffassung durch, dass das Mammakarzinom schon im Frühstadium eine im Körper gestreute Erkrankung sein kann und die Lymphknoten keine Barriere gegen eine Ausbreitung im Körper darstellen. Vielmehr wurde der Befall der Lymphknoten als Indikator für eine systemische Ausbreitung angesehen. Die Lymphknotenentfernung hätte folglich nur prognostische und keine therapeutische Bedeutung. Daher wurde das gängige Konzept der Operation und Strahlentherapie um eine anschließende Chemotherapie ergänzt, um auch Mikrometastasen zu vernichten. Ab 1969 erfolgte die Chemotherapie als Kombination mehrerer Präparate mit Verbesserung der Wirksamkeit.
Seit den 1970er Jahren werden Mammakarzinome zunehmend brusterhaltend operiert. Die Sentinel- oder auch Wächter-Lymphknoten-Entfernung erspart seit Ende des 20. Jahrhunderts oft die vollständige Entfernung der Lymphknoten aus der Achselhöhle. Damit wurde die operative Radikalität weiter reduziert.
Eine Forschergruppe um den US-Amerikaner J. M. Hall entdeckte 1990 das, später BRCA1 benannte, Brustkrebs-Gen. 1994 wurde mit BRCA2 ein zweites Brustkrebsgen erkannt.
Die 1985 von der American Cancer Society gestartete Initiative Brustkrebsmonat Oktober findet wachsende Beachtung in den Industrieländern. 2011 wurde der BRA Day ins Leben gerufen.
Brustkrebszeichen in der Kunst
In der medizinischen Fachliteratur wurde wiederholt über Brustkrebsanzeichen in historischen Bildern diskutiert. Anzeichen wie ein sich andeutender Tumor, Größen- und Umrissveränderungen der Brust im Seitenvergleich, Hautrötung, Hauteinziehung oder Apfelsinenhaut finden sich beispielsweise in Werken von Raffael, Rembrandt van Rijn und Rubens. Ob es sich bei den dargestellten Veränderungen allerdings tatsächlich um Brustkrebs handelt, lässt sich jedoch nicht beweisen und wurde daher auch angezweifelt.
- Beispiele für Brustkrebszeichen in der Kunst
Literatur
Leitlinien
- Interdisziplinäre S3-Leitlinie für die Früherkennung, Diagnostik, Therapie und Nachsorge des Mammakarzinoms. Version 4.1 – September 2018. AWMF-Registernummer: 32-045OL. Herausgeber: Leitlinienprogramm Onkologie der Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften e. V. (AWMF), Deutschen Krebsgesellschaft e. V. (DKG) und Deutschen Krebshilfe (DKH). Federführende Fachgesellschaften: Deutsche Gesellschaft für Gynäkologie und Geburtshilfe (DGGG) Langversion (PDF) Kurzfassung (PDF)
- AGO-Leitlinie (Arbeitsgemeinschaft Gynäkologische Onkologie): Empfehlungen gynäkologische Onkologie, Kommission Mamma Leitlinie 2018 (PDF)
- ESMO-Guidelines (European Society of Medical Oncology): E. Senkus, S. Kyriakides, S. Ohno, F. Penault-Llorca, P. Poortmans, E. Rutgers, S. Zackrisson, F. Cardoso on behalf of the ESMO Guidelines Committee: Primary breast cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. In: Annals of Oncology. Band 26, Supplement 5, 1. September 2015, S. v8–v30.
- NCI-Guidelines (National Cancer Institute, USA): Version für Patienten, Version für medizinisches Fachpersonal
- NCCN-Guideline (National Comprehensive Cancer Network, USA). William J Gradishar, Benjamin O Anderson, Ron Balassanian u. a.: NCCN Guidelines Insights Breast Cancer, Version 1.2017. Featured Updates to the NCCN Guidelines. In: Journal of the National Comprehensive Cancer Network. Band 15, Heft 4, 2017, S. 433–451.
Lehrbücher
- David J. Winchester, David P. Winchester, Clifford A. Hudis, and Larry Norton (Hrsg.): Breast Cancer (Atlas of Clinical Oncology). B.C. Decker, Hamilton, Ontario 2006, ISBN 1-55009-272-3 (eingeschränkte Vorschau in der Google-Buchsuche).
- Orlando Silva, Stefano Zurrida (Hrsg.): Brustkrebs: Diagnostik und Therapie. Urban & Fischer, München 2007, ISBN 3-437-24260-1 (eingeschränkte Vorschau in der Google-Buchsuche).
- Anne C. Regierer, Kurt Possinger: Mammakarzinom: Manual Diagnostik und Therapie. Deutscher Ärzte-Verlag, 2005, ISBN 3-7691-0487-0 (eingeschränkte Vorschau in der Google-Buchsuche).
- Manuela Eicher, Sara Marquard (Hrsg.): Brustkrebs. Lehrbuch für Breast Care Nurses, Pflegende und Gesundheitsberufe. Huber, Bern 2008, ISBN 978-3-456-84556-2.
Ratgeber
- Hermann Delbrück: Brustkrebs – Rat und Hilfe für Betroffene und Angehörige. 8. Auflage. Kohlhammer, Stuttgart 2009, ISBN 978-3-17-020469-0.
- Heinrich Schmidt-Matthiesen, Gunther Bastert, Diethelm Wallwiener (Hrsg.): Gynäkologische Onkologie. 7. Auflage. Schattauer, Stuttgart 2002, ISBN 3-7945-1974-4.
- Verschiedene Informationsbroschüren zum Thema „Brustkrebs“ der Deutschen Krebsgesellschaft. 2019 (krebsgesellschaft.de [PDF]).
- Clemens Unger: Metastasierendes Mammakarzinom: Patientinnen fragen – Ärzte antworten. Georg Thieme Verlag, Stuttgart 2004, ISBN 3-13-133561-0 (eingeschränkte Vorschau in der Google-Buchsuche).
- Marius Wunderle: Familiärer Brust- und Eierstockkrebs. Facharzt Sprechstunde. W. Zuckschwerdt, München 2019, ISBN 978-3-86371-244-0.
Dokumentationen
- Renate Zeun: Betroffen – Bilder einer Krebserkrankung. Verlag Volk und Gesundheit, Berlin 1990, ISBN 3-333-00380-5. (Renate Zeun studierte Fotografie, als sie an Brustkrebs erkrankte und operiert werden musste. Dieses Buch enthält ihre Diplom-Arbeit mit ihren eigenen Fotos ihrer Erkrankung und ihrem Umgang damit)
Weblinks
- Brustkrebs – Informationen bei Gesundheitsinformation.de (Online-Angebot des Instituts für Qualität und Wirtschaftlichkeit im Gesundheitswesen)
- Patientenleitlinie Brustkrebs: Die Ersterkrankung und DCIS – Eine Leitlinie für Patientinnen. (PDF; 0,48 MB) Deutsche Krebsgesellschaft
- Patientenleitlinie Brustkrebs: Die fortgeschrittene Erkrankung, Rezidiv und Metastasierung (PDF; 1 MB) Deutsche Krebsgesellschaft
- Übersicht nationale, europäische und internationale Brustkrebs-Leitlinien Breast Cancer Action Germany
- Brustkrebs. (Memento vom 13. November 2012 im Internet Archive; PDF; 860 kB) die blauen Ratgeber Nr. 2 der Stiftung Deutsche Krebshilfe
- Patientenratgeber Brustkrebs (PDF; 1,5 MB) Deutsche Krebsgesellschaft
- Weibliche Sexualität bei Brustkrebs. (PDF; 812 kB) Krebsliga Schweiz
- Brustkrebs. Krebsinformationsdienst des Deutschen Krebsforschungszentrums (DKFZ), Heidelberg
- Patienteninformationen zu Brustkrebs. Internetportal der Deutschen Krebsgesellschaft
- Entscheidungshilfen: Brustkrebs – Was kommt danach? und Brusterhaltende Therapie oder Brustentfernung? AOK
- Informationen zu Brustkrebs. Zentrum für Krebsregisterdaten im Robert Koch-Institut
- Sterblichkeitsrate bei Brustkrebs in Deutschland nach Bundesland und Geschlecht im Jahr 2017. Veröffentlicht von Rainer Radtke am 18. August 2022. In: Statista-Website. Statista, 18. August 2022, abgerufen am 20. Oktober 2022 (Die Statistik zeigt die Sterblichkeitsrate bei Brustkrebs (ICD-10 C50) in Deutschland im Jahr 2017 nach Bundesland und Geschlecht je 100.000 Einwohner. Beispiel: Im Jahr 2017 starben in Mecklenburg-Vorpommern durchschnittlich 20,3 Frauen je 100.000 Einwohner aufgrund von Brustkrebs.).