Hydrochinon
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Hydrochinon | |||||||||||||||||||||
| Andere Namen |
|
|||||||||||||||||||||
| Summenformel | C6H6O2 | |||||||||||||||||||||
| Kurzbeschreibung |
farb- und geruchloser, kristalliner Feststoff |
|||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 110,11 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest |
|||||||||||||||||||||
| Dichte |
|
|||||||||||||||||||||
| Schmelzpunkt |
170 °C (α-Form) |
|||||||||||||||||||||
| Siedepunkt |
286 °C |
|||||||||||||||||||||
| Dampfdruck |
15 mPa (20 °C) |
|||||||||||||||||||||
| pKS-Wert |
|
|||||||||||||||||||||
| Löslichkeit |
löslich in Wasser: 72 g·l−1 (20 °C) |
|||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK |
|
|||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Hydrochinon (1,4-Dihydroxybenzol) ist ein Phenol und neben Brenzcatechin (1,2-Dihydroxybenzol) und Resorcin (1,3-Dihydroxybenzol) das dritte mögliche Dihydroxybenzol. Hier befinden sich die beiden Hydroxygruppen in der para-Stellung.
Inhaltsverzeichnis
Entdeckung
Friedrich Wöhler erhielt 1844 bei der trockenen Destillation (> 280 °C) der Chinasäure ein Produktgemisch, das neben Benzol, Benzoesäure und Salicylsäure als Hauptbestandteil eine neue farblose Verbindung enthielt. Nach Lösen des Destillats in Wasser, Abfiltrieren der unlöslichen Anteile und Abdestillieren der leichter flüchtigen Komponenten, kristallisierte aus der zurückbleibenden Lösung zunächst Benzoesäure und aus deren Mutterlauge letztendlich Hydrochinon aus, das er durch wiederholte Umkristallisation in Form von farblosen, sechsseitigen Prismen rein erhielt.
Vorkommen
Hydrochinon kommt als ca. 10%ige Lösung zusammen mit 28%igem Wasserstoffperoxid in Abwehrdrüsen der Bombardierkäfer vor. Im Verteidigungsfall wird dem Gemisch Katalase zugemischt und dem Angreifer als 100 °C heißes, ätzendes Abwehrmittel entgegengespritzt. Die Blätter der Bärentraube wie auch Birnen enthalten das Glycosid Arbutin, bei dem es sich um Hydrochinon-β-D-Glucosid, also eine Verbindung von Hydrochinon mit Glucose handelt. Doppelfüßer aus der Ordnung Spirobolida können aus seitlich am Körper angelegten Drüsen Wehrsekrete ausstoßen, die teilweise Hydrochinon enthalten.
Darstellung
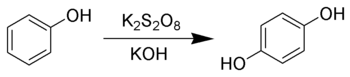
Hydrochinon kann durch die Elbs-Oxidation aus Phenol synthetisiert werden.
Eigenschaften
Hydrochinon ist ein farbloser Feststoff, der in vier polymorphen Kristallformen auftreten kann. Unter Normaldruck existieren die α-, β- und γ-Form. Die α- und β-Form kristallisieren in einem hexagonalen Kristallgitter, die γ-Form in einem monoklinen Gitter. Bei Raumtemperatur ist die α-Form die thermodynamisch stabile Form. Die β- und γ-Form sind metastabil und können sich spontan in die α-Form umwandeln. Der α-Form entspricht das kommerzielle Produkt. Die β-Form kann aus Clathraten mit kleinen Molekülen wie Methanol erhalten werden. Die γ-Form kann über eine Sublimation oder schnelle Verdampfung gewonnen werden. Bei höheren Drücken oberhalb von 40 MPa kann die δ-Form als vierte Kristallform nachgewiesen werden. Der Schmelzpunkt der δ-Form liegt bei 78,5 MPa bei 191 °C. Der Tripelpunkt zwischen α-, δ- und flüssiger Phase liegt bei 176 °C und 15,7 MPa.
Hydrochinon ist ein stärkeres Reduktionsmittel als Brenzcatechin, da das aus Brenzcatechin entstehende o-Benzochinon energiereicher und somit ein stärkeres Oxidationsmittel ist. Ursache für Letzteres ist die elektrostatische Abstoßung der benachbarten Carbonylgruppen.
Es lässt sich durch Oxidation in Benzochinon (Chinon) überführen:
Bei dieser Reaktion entsteht als Zwischenprodukt der tieffarbige, schwer wasserlösliche Charge-Transfer-Komplex Chinhydron (nicht abgebildet).
Reaktionen
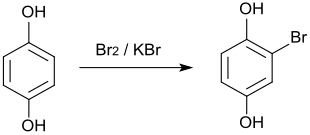
Die einfache Bromierung von Hydrochinon mit Kaliumbromid und Brom in Tetrachlorkohlenstoff führt zum Bromhydrochinon.
Vollständige Bromierung zum analytischen Nachweis liefert das 2,5-Dibromhydrochinon, dessen Schmelzpunkt bei 186 °C liegt. Ebenfalls bekannt ist das Tetrabromhydrochinon, welches jedoch aus Benzochinon dargestellt wird.
Methylierung mit Dimethylsulfat ergibt das 1,4-Dimethoxybenzol, dessen Schmelzpunkt bei 56 °C liegt.
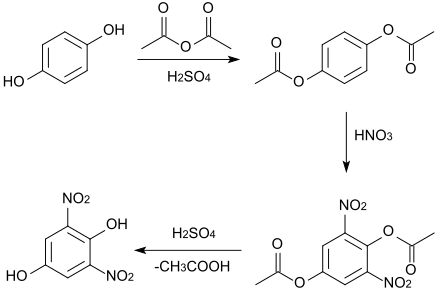
Eine direkte Nitrierung des Hydrochinons ist nicht möglich, da es dabei zerfällt. Die Hydroxygruppen müssen daher durch Reaktion mit Essigsäureanhydrid und Schwefelsäure als Katalysator mit Acetylgruppen geschützt werden, dann findet eine Nitrierung an den Positionen 2 und 6 statt. Die Verseifung des entstehenden Dinitrodiacetylhydrochinons führt schließlich zu 2,6-Dinitrohydrochinon (Schmelzpunkt 135–136 °C).
Verwendung
In der Fotolabortechnik wird Hydrochinon als Reduktionsmittel zum Entwickeln von Filmen und Bildern eingesetzt. Wegen der Gefahren für Umwelt und Gesundheit gibt es Bestrebungen, die Substanz für diese Anwendungen nach Möglichkeit durch weniger riskante Stoffe zu ersetzen. Es wird auch als Inhibitor für Radikalreaktionen genutzt, um die Bildung von Etherperoxiden zu verhindern.
Hydrochinon ist im Annex II (Liste der unerlaubten Stoffe) der Kosmetikverordnung aufgeführt, somit ist die kosmetische Verwendung – etwa in Hautcremes zur Hautaufhellung – in den Ländern der EU verboten.
Toxikologie
Es gibt keine Studien zur direkten Toxizität von Hydrochinon im Menschen. Allerdings wurde in mehreren Studien an Tieren gezeigt, dass Hydrochinon für die Niere toxisch ist. Außerdem ist Hydrochinon immunotoxisch und spielt vermutlich auch bei der Immunotoxizität von Benzen eine bedeutende Rolle.
Wenn Hydrochinon dermal aufgetragen wird kann es zu allergischen und auch systematischen allergischen Reaktionen kommen.
Kanzerogenität
Zum Menschen liegen zwei Kohortenstudien vor, einmal von dänischen Lithographen und von Industriearbeitern, in denen der Zusammenhang zwischen einer Exposition mit Hydrochinon und dem Auftreten von Krebs allgemein und auch spezifischen Tumoren untersucht wurde. In keiner der beiden Studien konnte ein Zusammenhang festgestellt werden, auch wenn sich unter den Lithographen eine erhöhte Inzidenz an Melanomen zeigte.
In Rattenversuchen konnte bei wiederholter Gabe von Hydrochinon ein erhöhtes Auftreten bestimmter Tumore in der Leber und der Niere gezeigt werden.
Es wird daher angenommen, dass Hydrochinon, wie auch andere Dihydroxybenzene (z. B. Catechol) karzinogen und genotoxisch ist.
Mögliche Wirkmechanismen
In Versuchen an Leberzellen führte Hydrochinon zu einer Depletion von Antioxidanzien in der Zelle, konkret von Glutathion. Außerdem konnte in der Zellkultur gezeigt werden, dass Hydrochinon DNA-Addukte bildet und die Bildung von 8-OHdG, einem Standardmarker für DNA-Schäden, erhöht. Es wird angenommen, dass diese DNA-Schäden im Zusammenhang mit der Bildung von ROS stehen.
Metabolismus
Hydrochinon wird im Menschen hauptsächlich zu Sulfat- und Glucoronidkonjugaten verstoffwechselt. Im Rahmen dieser Stoffwechselwege entsteht neben reaktiven Intermediaten, wie zum Beispiel Semichinone und ROS, auch 1,4-Benzochinon. Diese Verstoffwechselung wird durch eine Reihe von Oxidasen katalysiert. Damit ist der Metabolismus von Hydrochinon dem von Catechol ähnlich.
Gefahrenbewertung
Hydrochinon wurde 2012 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Hydrochinon waren die Besorgnisse bezüglich der Einstufung als CMR-Stoff, Verbraucherverwendung, hoher (aggregierter) Tonnage, hohes Risikoverhältnis (Risk Characterisation Ratio, RCR) und weit verbreiteter Verwendung. Die Neubewertung fand ab 2012 statt und wurde von Italien durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht.