Künstliche Bauchspeicheldrüse
Als künstliche Bauchspeicheldrüse, künstliches Pankreas oder künstliche Betazelle wird ein medizintechnisches Gerät bezeichnet, das Patienten mit Diabetes mellitus in Abhängigkeit von kontinuierlichen Messungen des Blutzuckerspiegels mit Insulin versorgt. Sie simuliert damit die Funktionsweise der in den Langerhans-Inseln der Bauchspeicheldrüse vorkommenden Betazellen, die im Körper die Insulinproduktion und -freisetzung realisieren und die bei Diabetikern zerstört oder in ihrer Funktion eingeschränkt sind. Die Funktion einer künstlichen Bauchspeicheldrüse entspricht damit der natürlichen Insulinfreisetzung mehr als die konventionelle Insulintherapie oder die Behandlung mit Hilfe einer Insulinpumpe.
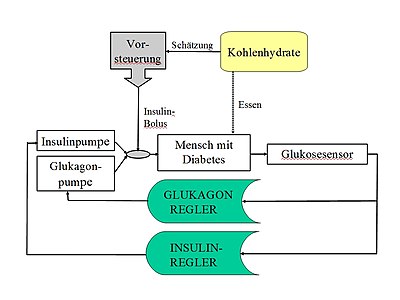
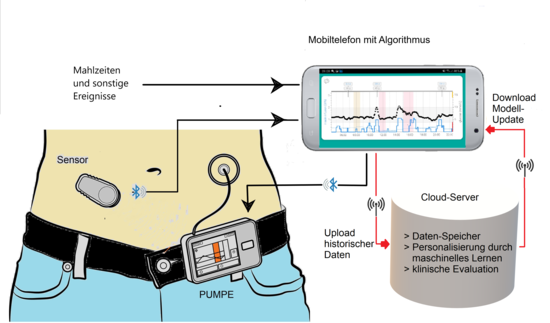
Die wesentlichen Komponenten einer künstlichen Bauchspeicheldrüse sind ein kontinuierlich messender Glucosesensor zur Bestimmung des Blutzuckers, eine Pumpe zur gesteuerten Insulinabgabe sowie ein miniaturisierter Computer, der die Messdaten des Sensors auswertet und durch einen Algorithmus zur Simulation des Glukose-Insulin-Regelkreises die Pumpe steuert. Die künstliche Bauchspeicheldrüse befindet sich seit etwa 1970 in der Entwicklung, ab dem Ende der 1970er Jahre wurden erstmals entsprechende Systeme am Menschen getestet. Ziel ist der Langzeiteinsatz als Implantat oder als ein vom Patienten tragbares Gerät. Gegenwärtig ist die künstliche Bauchspeicheldrüse noch immer Gegenstand der Forschung. Kommerzielle Systeme und Do-it-Yourself-Systeme sind seit etwa 2018 im Umlauf.
Inhaltsverzeichnis
- 1 Geschichte
- 2 Untergruppen, Typen
- 3 Reglertypen
- 4 Risikoreduktion und Sicherheitsarchitektur
- 5 Besonderheiten und Schwierigkeiten
- 6 Ziele und Metriken für die Leistungsfähigkeit
- 7 Forschungsschwerpunkte weltweit
- 8 Stand der Technik
- 9 Nicht-kommerzielle Systeme
- 10 Kommerzielle Systeme
- 11 Literatur
- 12 Einzelnachweise
Geschichte
Erstmals wurde 1964 von Kadish ein Regelkreis beschrieben. Ab 1974 versuchten weltweit mehrere Forschergruppen dem Ziel einer geregelten Insulininfusion näher zu kommen, darunter Albisser (USA), Kreagen (Australien), Mirouze (Frankreich) und Shishiri (Japan). In Deutschland wurde durch E.F. Pfeiffer († 23. Januar 1997) in Ulm an der Entwicklung gearbeitet. In Karlsburg in der DDR wurde durch U. Fischer und Kollegen zeitgleich an einem System mit einem mathematischen Modell und einem Glucosesensor geforscht. In Japan brachte zur gleichen Zeit M. Shishiri ein subkutan messendes Gerät heraus. Beiden gelang nicht die klinische Weiterentwicklung zu miniaturisierten Geräten. Großgeräte mit nicht implantiertem Sensor und Glukose-Gegeninfusion wurden in dieser Zeit in eine kommerzielle Produktion gebracht (Biostator und Nikkiso STG-22 Blood Glucose Controller). Ab 1978 wurden durch Pickup in England und Tamborlane in USA die ersten subkutanen Insulinpumpen betrieben. Erst nachdem zuverlässige und implantierbare kontinuierliche Glukosesensoren in großen Stückzahlen produziert werden konnten, kam es ab 2004, vornehmlich in den USA, wieder zu zahlreichen Entwicklungen. Seit 2000 wurde die Forschung am künstlichen Pankreas durch massive Unterstützung von Institutionen wie JDRF, National Institutes of Health und die Europäische Union gefördert. Insbesondere förderte die JDRF die Entwicklung eines Typ-1-Simulators, welcher – nach Anerkennung durch die FDA – Studien massiv beschleunigte und Experimente am Menschen teilweise überflüssig machte. Tragbare Steuerungen konnten ab 2011 durch Übertragung der Software auf Android-Smartphones (System DIAS) erreicht werden.
Untergruppen, Typen
Es gibt unterschiedliche Ausführungen, welche sich unterscheiden durch
- Lage des Sensors und des Insulinkatheters: subkutan, intravenös oder intraperitoneal
- Grad der Automatisierung
- Grad der Miniaturisierung, ggf. implantiert
- Ort der Anwendung: Intensivstation, stationär, ambulant
- Zielbereich oder exakter Zielwert
- Insulin allein oder bi-hormonal mit Glukagon bzw. Pramlintide
- Art des Regel-Algorithmus, zum Beispiel Auswertung der Herzfrequenz
Einige Typen werden nachfolgend beschrieben.
Schwellenwert-Unterbrechungssystem
Das Ziel eines Schwellenwert-Unterbrechungssystems für Insulin (engl. threshold suspend device system) ist die Reduktion der Schwere bzw. die Umkehrung eines gefährlichen Blutglucoseabfalls (Hypoglykämie) durch eine zeitlich begrenzte Unterbrechung der Insulinzufuhr mittels Pumpe, wenn der Glucosespiegel einen Schwellenwert erreicht oder sich diesem annähert.
Eine Weiterentwicklung stellen Systeme dar, welche die Erreichung der Schwelle vorhersagen (Prädiktion, engl. predictive low-glucose suspend PLGS). In einer Studie aus USA mit prädiktiver Abschaltung lagen in den Nächten mit PLGS 78 % der Blutglucosewerte zwischen 70 und 200 mg/dl im Vergleich zu 71 % ohne eine solche prädiktive Abschaltung.
Bereichsregelungssysteme
Ein Bereichsregelungssystem (engl. Control-to-range, CTR) reduziert die Wahrscheinlichkeit von Hyper- oder Hypoglykämien dadurch, dass es die Insulindosis verändert, wenn sich die Blutglukose einem hohen oder niedrigen Schwellenwert nähert. Menschen, die diese Art von System wählen, müssen weiterhin Insulin selbst injizieren, eine Blutzuckerkontrolle durchführen und die Insulindosis diesen Werten anpassen.
Sollwert-Regelsysteme
Sollwert-Regelsysteme (engl. Control-to-target, CTT) versuchen diesen Soll- oder Zielwert jederzeit zu erreichen. Das System arbeitet vollautomatisch und benötigt außer Kalibrationen keine Einbeziehung des Benutzers.
Bi-hormonales Regelsystem

Ein bi-hormonales Regelsystem soll einen Glucose-Sollwert durch zwei Algorithmen erreichen, die jeweils eine Pumpe für ein senkendes Hormon (Insulin) und ein anhebendes Hormon (Glucagon) ansteuern. Durch diese Art der Regelung ahmt man die Glucose-Regulation eines gesunden Organismus besser nach. Glucagon wird beim Gesunden in den α-Zellen des Pankreas gebildet und ist als Medikament für die parenterale Anwendung bei schwerer Hypoglykämie bisher zugelassen.
Nachteile:
Die Langzeit-Sicherheit von Glucagon wurde noch nicht erprobt. Wegen der Fibrillen- und Aggregatbildung in wässriger Lösung und der Degradation ist eine stabile Formulierung schwierig.
Vorteil:
Glucagon besitzt eine schnellere Anflutungszeit als Insulinanalogon (ca. 20 Min bis zum Maximum.)
Hybridsystem mit Vorsteuerung
Ein Hybridsystem erlaubt dem Patienten, sich eine zusätzliche Insulindosis vor Mahlzeiten zu verabreichen. Diese Zusatzdosis vermindert das Risiko von Hyperglykämien nach der Mahlzeit. Das in der Regelungstechnik übliche Verfahren der Vorsteuerung (engl. feed forward) zur Ausregelung von erwarteten Störgrößen wird hier partiell umgesetzt. Da die Störung nicht exakt erfasst, sondern nur vom Nutzer geschätzt werden kann (Kohlenhydrat- bzw. KE-Schätzung) wird eine partielle Vorsteuerung betrieben, bei welcher z. B. 50 % der berechneten Insulindosis als Bolus vorab injiziert werden. Man gibt somit das Prinzip der vollautomatischen Kontrolle zugunsten einer besseren Ausregelung von Mahlzeiten auf, was die Mithilfe des Nutzers erfordert.
Reglertypen
Modell-prädiktive Regler
Modell-prädiktive Regler (englisch Model Predictive Control MPC) werden eingesetzt, wenn gängige Regler (PID) nicht die notwendige Güte aufweisen und genügend Zeit bleibt, bei jedem Abtastschritt die Regelung zu optimieren. Sie können nach jeder Abtastung (Messung) die Regelparameter basierend auf einer Prädiktion neu berechnen.
Proportional-Integral-Differential-Regler (PID)
Dieser Reglertyp besteht aus drei Komponenten: (a) der proportionale Anteil, bei der die Stellgröße (Infusionsrate) proportional zur Regeldifferenz (Glukose-Istwert – Glucose-Sollwert) wird. (b) Ein Integrier-Glied, welches für die stationäre Genauigkeit sorgt, jedoch das Antwortverhalten verlangsamt. (c) ein Differenzierglied, welches auf Änderungen reagiert, den Regler schnell macht, aber schnelle Störungen verstärkt und den Regler instabil machen kann. Ab 2010 haben solche Regler – in Anlehnung an die physiologisches Regelung eines gesunden Pankreas – eine Rückkopplung vom (vorhergesagten) Insulinspiegel erhalten (IOB), um Hypoglykämien durch eine Überinsulinierung vorzubeugen.
2017 kam mit dem Minimed 670G ein System allein in USA auf den Markt, bei welchen die Basalrate mittels eine PID-Algorithmus mit IOB-Rückkopplung geregelt wird. Dieses System erfasst keine Mahlzeiten, ist also als ein Hybrid System (s. o.) einzustufen.
Fuzzy-Regler
Fuzzy-Regelung besteht aus einem Regler, welcher eine Anzahl diskrete Eingangswerte (z. B. drei Glukosebereiche: hoch, normal, niedrig) durch Fuzzy-Regeln ('wenn'- 'dann' – Regeln) einen Ausgangswert (Insulin-Infusions-Rate) ergeben. Hier werden Näherungswerte für die Insulindosen aus empirischem Wissen generiert, welches nahe an Dosiempfehlungen von Diabetologen ist. Somit lehnt sich die Fuzzy-Regelung an die gängige Praxis der Bolus-Berechnung im Alltag an: Der Patient korrigiert zwischen 140 und 170 mg/dl mit einer Insulineinheit (iE) und zwischen 170 und 200 mg/dl mit 2 iE usw.
Risikoreduktion und Sicherheitsarchitektur
Eine Fehlmessung durch den Sensor und/oder eine unrichtige Steuerung durch den Regelalgorithmus kann prinzipiell zu einer lebensgefährlichen Hypoglykämie führen. So ist z. B. eine technische Begrenzung der Infusionsrate durch einen separaten Hypoglykämie-Prädiktionsalgorithmus möglich. Dazu dient zum Beispiel ein low glucose dectection module oder eine Insulin-on-Board-Berechnung.
Besonderheiten und Schwierigkeiten
Eine Besonderheit bei der Rückkopplung sind die großen Zeitverzögerungen im Prozess: eine physiologische und damit unbeeinflussbare Wirk-Verzögerung ist die Insulinwirkung in der Leber von etwa 100 min und im peripheren Gewebe (Muskel) von etwa 20 min. Hinzu kommen bei der gegenwärtig präferierten sc-sc-Anwendung an beiden Enden potentiell veränderbare Verzögerungen hinzu: die im Glucosesensor und der Gewebsdiffusion begründete lag time von etwa 5–15 min und die bei der Insulinabsorption entstehende Verzögerung. Ein künstliches Pankreas kann aufgrund der Verzögerungen und Ungenauigkeiten bei der Messung und der Insulin-Verabreichung bisher nicht optimal arbeiten. Störungen, also schnelle Veränderungen wie eine Mahlzeit, die einen Glucoseanstieg bewirken, der viel schneller verläuft, als die notwendige Zeit für Insulinabsorption und Wirkung, können nicht ausgeregelt werden. Eventuell wird der Regler instabil, weil der Regeleingriff zu stark oder zu schnell erfolgt. Also muss der Regler langsamer ansprechen, wodurch jedoch postprandiale Glucosespitzen weniger abgemildert werden und spätere Hypoglykämien eintreten können. Wegen dieses „Kontroll-Dilemmas“ sind die Regler nur langsam und arbeiten nur über Nacht im Quasi-Ruhezustand gut. Zusammen mit dem Sport sind Mahlzeiten diejenigen Störungen, die man mit einem künstlichen Pankreas besonders gern ausregeln würde. Somit sind die Systeme oft noch Hybrid-Systeme. Andere Insulin-Applikationsformen wie intraperitoneale Gabe oder Inhalation könnten helfen.
Ziele und Metriken für die Leistungsfähigkeit
- kompletter oder weitgehender Übergang aller Tätigkeiten des Diabetes-Managements vom Patienten auf das Gerät (Entlastung)
- Stabilisierung und Senkung der mittleren Glykämie mit langfristiger Senkung der Folgeschäden
- Vermeidung oder Reduktion von Akutkomplikationen wie Hypoglykämien und ketoazidotischen Komata,
So wird vorgeschlagen, die Qualität und Variabilität mittels Zeitdauer im Zielbereich (time in target, TIR) zu erfassen, was durch die kontinuierliche Glucosemessung (CGM) möglich ist. Hybridsysteme (s. o.) erreichen derzeit, dass in etwa 70 % der Messzeit die Glucosewerte im Bereich 70–180 mg/dl liegen. Zusätzlich ist es sinnvoll, die Zeit im hypoglykämischen Bereich zu erfassen. Ferner wird die Messung der Lebensqualität eine immer bedeutendere Rolle einnehmen. Es gibt validierte Instrumente diese zu messen z. B. Erfassungsbögen für Diabetes Quality of Life oder Fear of Hypoglycemia.
Letztlich ist immer ein Kompromiss herzustellen zwischen dem Grad der Automatisierung und der Reglergüte; genau so ein Kompromiss zwischen Erreichen der Euglykämie und Anzahl von unerwünschten Hypoglykämien. Der teilweise Übergang an den Nutzer birgt auch Gefahren, die in unvorhersagbarem menschlichen Verhalten begründet liegen und Sicherheitsbedenken aufkommen lassen.
Vergleichsmetriken werden durch nationale Register oder Qualitätsinitiativen („Nicht-Unterlegenheit“ durch beste bisherige Vergleichstherapie) hergestellt. In Deutschland ließ sich beispielsweise durch ein im Krankenhaus initiiertes kombiniertes Therapie- und Schulungsprogramm mit den Methoden des Qualitätsmanagements zeigen, dass Menschen mit Diabetes Typ-1 mittels intensivierter Insulintherapie (ICT) im Durchschnitt einen HbA1c von 7,3 % erreichen können sowie eine HbA1c-unabhängige Zahl von schweren Hypoglykämien von 0,14/Pat./Jahr.
Forschungsschwerpunkte weltweit
| AP System | Algorithmus | Entwickler | Dauer der Regelung |
Mahlzeiten (Vorsteuerung) |
Sport incl. | außer Haus | Pumpe Sensor |
|---|---|---|---|---|---|---|---|
| PID Regler (USA) | PI/PD-IFB | G.Steil | 14 Std. | n | n | n | Animas Pumpe, Abbott Free Style Navigator |
| MD-Logic (Isr/D/Slo) | Fuzzy | E.Atlas | N/A | N/A | j | j | Enlite;Veo pump (Medtronic) |
| DIAS(USA/It/Fr) | MPC | Kovatchev/Cobelli/ Renard/Zisser |
40 std | j | n | j | Tandem Pumpe, DexCom G4 |
| Florence (En/USA) | MPC | R.Hovorka | 8 Std. | j | n | n | Dana R Diabecare; Abbott Free Style Nav |
| Bionic Dual Hormon (USA) |
Insulin und Glucagon adapt. MPC |
Damiano | 120 Std. | j | j | j | Tandem t:slim; Dexcom G4 |
| AP@home (EU) | MPC | Mehrere Autoren | N/A | j | N/A | j | Omnipod Pumpe; Dexcom seven+ |
| 12 Week 24/7 (USA/It) | MPC Zone | mehrere Autoren | 12 Wochen | j | n | j | Roche AccuCheck Combo Spirit, Dexcom G4 |
| Tandem mit TypeZero Tech, (USA) | Control-IQ Technologies | iDCL Trial Research Group | 6 Monate | j | n | j | t:slim X2 Insulin Pumpe (Tandem) mit Control-IQ, (TypeZero), Dexcom G6 Sensor |
Anmerkungen: nicht vollständige Auswahl, eine vollständige Auswahl ist in der Articial Pancreas Clinical Trial Database zu finden; MPC = Model predictive control, IFB = Insulin-feedback, J= erfüllt N = nicht erfüllt N/A = unbekannt;
Stand der Technik
Um 2020 sind sogenannte sc-sc Systeme in der Anwendung, bei welchem der Glucosesensor wie auch der Infusions-Katheter für Insulin im subkutanen (SC) Gewebe liegt. Auch wenn bei einer intravenösen Messung bzw. Infusion wesentliche Verzögerungen wegfallen würden, geht man bisher aus Sicherheitsgründen den Weg über das subkutane Kompartment. Die Systeme können so ausgelegt werden, dass drahtlose Verbindungen (Bluetooth) und die komplette Software zur Ansteuerung auf einem Mobilfunkgerät (smart phone) installiert werden können. Prinzipiell ist auch einer Fernüberwachung (Telemonitoring) möglich.
Ein System mit CE-Kennzeichnung war 2015 in europäischen Ländern erhältlich und im deutschen Hilfsmittelverzeichnis der gesetzlichen Krankenversicherung gelistet. Weitere Systemanbieter hatten im Jahre 2015 kommerzielle Absichten.
In den Vereinigten Staaten hat die FDA die Interoperabilität von technischen Geräten und APPs beim Diabetes zugelassen, wenn sie die sogenannte iCGM Kennzeichnung tragen. Damit können kontinuierlich messende Glucosesensoren, Insulinpumpen, und APPs mit Regelalgorithmen verschiedener Hersteller miteinander verbunden werden und so miteinander kommunizieren.
Die Studien mit realen Patienten zielen darauf ab, die Anwendungen auf immer längere Perioden auszuweiten und den Nutzern mehr Selbstständigkeit zu ermöglichen. Zunächst wurde das in sogenannten Diabetes-Camps mit Aufsicht, später in kliniknahen Hotels praktiziert.
In einer Studie im Jahre 2015 in England wurde eine sichere Anwendungen bis zu drei Monaten zu Hause und eine Erhöhung der Zeit mit Werten im Zielbereich (TIR) um 11 % beschrieben. In einer multizentrischen Studie (vorwiegend USA) wurde 2017 über 12 Wochen bei 29 Erwachsenen ein System ambulant getestet, welches eine Vorsteuerung der Mahlzeiten beinhaltete. Neu war hier wöchentliche Adaptation der Basalrate und des Insulin-zu-Kohlenhydrat-Verhältnisses (welche den sog. Mahlzeitenbolus bestimmt) auf entfernten Servern. Dadurch konnte der HbA1c von ursprünglich 7 % auf 6,7 % gesenkt werden. In einer multizentrischen Studie von 2019 an 112 Patienten über 6 Monate wurde eine ähnliche Erhöhung der TIR (Zeitdauer im Zielbereich) erzielt.
In einer Studie aus Amerika erbrachten die von Kindern und ihren Eltern selbst berichteten Ergebnisse bezüglich Lebensqualität (strukturierter Fragebogen) beim Tragen eines künstlichen Pankreas (Tandem Control-IQ System) keine signifikanten Vorteile gegenüber einer Therapie mittels einer Insulin-Pumpe.
Eine kurze Studie der Firma INREDA (Amsterdam) konnte 2021 mit einem bihormonalen System (Insulin + Glucagon) eine Verbesserung der TIR von 54 % auf 87 % erzielen, ohne dass die Patienten manuelle Eingaben und Berechnungen (Kohlenhydrate bestimmen, Insulindosis vor dem Essen injizieren) durchführen mussten. Allerdings ist das System deutlich komplexer und wartungsaufwendiger (insbesondere wegen des Umgangs mit Glucagon).
Nicht-kommerzielle Systeme
Seit 2013 existiert unter dem Motto „We are not waiting“ (Wir wollen nicht warten) OpenAPS, eine weltweite Do-it-yourself-Community, die die Verknüpfung kommerzieller Technologien zu einem künstlichen Pankreas mittels Algorithmen und Software im Sinne von Open Source betreibt. Zu den Gründern zählen Dana Lewis und Scott Leibrand aus den USA.
Wie bei kommerziellen Systemen handelt es sich bei OpenAPS bzw. bei dem etwas neueren AndroidAPS um Hybridsysteme, d. h. vor jeder Mahlzeit muss ein Insulinbolus abgegeben werden. Es werden eine kommerziell verfügbare Insulinpumpe und ein CGM-System eingesetzt, die über eine offene Schnittstelle verfügen. Als Medizinprodukte der Klasse IIa und IIb setzt das In-Verkehr-Bringen eine CE-Kennzeichnung voraus. Um juristischen Problemen zu entgehen, muss der Nutzer sein Produkt selber zusammenbauen. So lässt sich die zugehörige APP nicht aus einem APP-Store herunterladen, sondern die APP selbst erstellt werden, was Software-Kenntnisse voraussetzt. Der zugehörige Quellcode ist frei verfügbar. Es werden dem Nutzer keine Serviceleistungen zur Verfügung gestellt. Ferner gibt es keine Haftung bei wirtschaftlichen oder gesundheitlichen Schäden infolge des Gebrauchs.
Die Mitgliedschaft in einem sozialen Netzwerk wie Facebook ist erforderlich, um sich mit anderen „Loopern“ auszutauschen. Die Community erwartet, dass Nutzerdaten anonym gespendet werden. Nach einer Schätzung der Organisation OpenAPS gab es im Dezember 2021 fast 2500 Nutzer weltweit. Aus einer Umfrage bei fast 900 Erwachsenen und Eltern von Kindern geht hervor, dass sich der HbA1c durch die Anwendung von openAPS im Mittel um fast 1 % gesenkt hat.
Kommerzielle Systeme
| System | Beschreibung | Verfüg-
bar |
Regu-
liert |
Pumpe | Sensor | Daten | Algo-
rithmus |
Studien | Besonderheiten |
|---|---|---|---|---|---|---|---|---|---|
| CamAPS FX (UK) | Android-basierte APP für Hybrid
AP mit Bolusrechner für Mahlzeiten |
UK
EU (teilweise) |
CE,FDA
Kl IIb |
Dana | Dexcom G6 | Daten-Upload
auf Server des Herstellers |
MPC | ||
| DBLG1
Diabeloop (F) |
Handset mit gesicherte Bluetooth-verbindung, welche die Kontroll-
algorithmen enthält. 6 konfigurierbare Parameter |
F
D |
CE
Kl IIb |
Kaleido
(Vicentra) |
Dexcom G6 | Daten auf Server
'YourLoops' durch Nutzer freigebbar |
MPC | lernfähiger
Bolusrechner |
|
| Medtronic MiniMed
670G (USA) |
Anpassung der Basalrate
Mahlzeitenbolus-Berechnung nach Eingabe der KH-Menge |
USA
EU |
CE
Kl IIb FDA |
Minimed
670 G |
Guardian
Sensor 3 |
Upload über CareLink | PID mit
IOB-Rückkopplung |
||
| Control-IQ
Tandem (USA) |
'Auto-correction' Funktion
Bolusrechner vorhanden |
USA | FDA | t:slim X2 | Dexcom G6 | Upload auf
t:connect portal |
MPC
TypeZero |
Schlaf und Sport
Modus |
Literatur
- Frederick Chee, Tyrone Fernando: Closed-Loop Control of Blood Glucose. Reihe: Lecture Notes in Control and Information Sciences, Band 368. Springer, Berlin und New York 2007, ISBN 978-3-540-74030-8
- C.Cobelli, E. Renard, B.Kovatchev: Artificial Pancreas: Past, Present, Future. In: Diabetes, 2011, 60, S. 2672; doi:10.2337/db11-0654
- Masami Hoshino, Yoshikura Haraguchi, Iwanori Mizushima, Motohiro Sakai: Recent Progress in Mechanical Artificial Pancreas. In: Journal of Artificial Organs, 12(3)/2009. Springer, S. 141–149, ISSN 1434-7229.
- Kavita Kumareswaran, Mark L Evans, Roman Hovorka: Artificial Pancreas: An Emerging Approach to Treat Type 1 Diabetes. In: Expert Review of Medical Devices, 6(4)/2009. Expert Reviews Ltd., S. 401–410, ISSN 1743-4440.
- Martina Lenzen-Schulte: Typ-1-Diabetes: Diabetestherapie Marke Eigenbau. In: Deutsches Ärzteblatt. Band 116, Nr. 29-30, 2019, S. A 1378-A 1381 (aerzteblatt.de).