NMDA-Rezeptor
| NMDA-Rezeptor | ||
|---|---|---|

| ||
| EM-Struktur des NMDA-Rezeptors, komplexiert mit Esketamin, Glycin und Glutamat, gemäß PDB 7EU7. Untereinheiten GluN1 in orange-rot, GluN2A in blau, Liganden in magenta. Vorn/rechts Bänderdarstellung, hinten/links van-der-Waals-Oberfläche in grau. Teile der Struktur der Sicht wegen ausgeblendet. | ||
| Sekundär- bis Quartärstruktur | Heterotetramer | |
| Bezeichner | ||
| Gen-Name(n) | GRIN1, GRIN2A, GRIN2B, GRIN2C, GRIN2D, GRIN3A, GRIN3B | |
| Transporter-Klassifikation | ||
| TCDB | 1.A.10.1.6 | |
| Bezeichnung | glutamatgesteuerter Ionenkanal | |

NMDA-Rezeptoren gehören zu den ionotropen Glutamatrezeptoren. Das sind Ionenkanäle in der Zellmembran, die durch die Bindung ihres Liganden Glutamat aktiviert werden.
Inhaltsverzeichnis
Name
Der Name „NMDA-Rezeptor“ rührt daher, dass diese Rezeptoren durch die Bindung des für sie spezifischen Partialagonisten N-Methyl-D-Aspartat (NMDA) aktiviert werden können, der zwar im Körper normalerweise nicht vorkommt, im Experiment aber ebenso wie der „Originalagonist“ Glutamat zur Öffnung der Ionenkanal-Untereinheit des Rezeptors führt.
Funktion
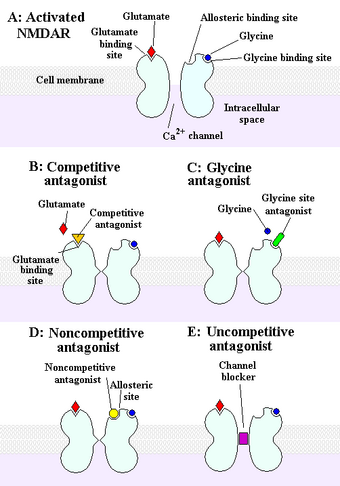
In der postsynaptischen Membran lokalisiert steuern sie nicht-selektiv für Kationen den Ionenfluss an der nachgeschalteten Nervenzelle der Synapse. Der Kanal besitzt verschiedene Bindungsstellen, an die unterschiedliche Liganden andocken und so die Rezeptor-Funktion steuern. Liganden sind vereinfacht als Botenstoffe zu verstehen, die an bestimmten Bindungstellen am Rezeptor binden und die Änderungen in der Struktur des Rezeptors/Kanals verursachen, was letztlich die Kanalleitfähigkeit beeinflusst. Neben der Bindungsstelle für den eigentlichen Botenstoff Glutamat (der somit als Agonist bezeichnet wird) und einer Bindungsstelle für den Coagonisten Glycin zeigt der NMDA-Rezeptor Bindungsstellen für Stoffe, die die Aktivität vermindern, so genannte NMDA-Antagonisten. Dabei wird unterschieden in eine Bindungsstelle für kompetitive Antagonisten (z. B. CPP oder APV), Bindungsstellen für Polyamine, Protonen und Zink-Ionen und eine Bindungsstelle für nicht-kompetitive Antagonisten. An diese Bindungsstelle im Inneren des Ionenkanals binden zum Beispiel dissoziative Drogen wie das Ketamin, das PCP oder das MK-801 (Dizocilpin) und wirken dort als Kanalblocker.
NMDA-Rezeptoren vermitteln im Vergleich zu AMPA-Rezeptoren eine langsamere postsynaptische Stromkomponente, deren Dauer im Bereich einiger hundert Millisekunden für synaptische Verschaltungen sehr lang andauert. Ihre Permeabilität in Prinzipalneuronen für Calcium liegt um das fünfzigfache höher als die der AMPA-Rezeptoren. Demgegenüber ist allerdings die Leitfähigkeit der NMDA-Rezeptoren bei negativen Membranpotentialen (< -30 mV) sehr gering, weil der Kanal mit Magnesium-Ionen blockiert ist.
Ein negatives Membranpotential, also ein Überschuss positiv geladener Ionen im Extrazellularraum gegenüber dem Inneren der Zelle, bezeichnet man als Ruhemembranpotenzial einer elektrisch erregbaren Zelle. Erregungszustände gehen mit einer Änderung des elektrischen Potentials über der Membran einher; das zahlenmäßige Verhältnis Außen : Innen positiver bzw. negativer Ionen gleicht sich lokal begrenzt einander an (Depolarisation). Erst bei ausreichender Depolarisierung der postsynaptischen Membran tragen auch die NMDA-Rezeptoren zum synaptischen Strom bei. Diese Eigenschaft, nur bei gleichzeitiger prä- und postsynaptischer Aktivität leitfähig (insbesondere für Calcium) zu sein, macht die NMDA-Rezeptoren zu idealen molekularen Koinzidenzdetektoren. Das gleichzeitige Eintreten beider Ereignisse (nämlich erregter prä- und postsynaptischer Nervenzellen) ist nicht der Regelfall und deutet darauf hin, dass die entsprechende Synapse zwischen zwei Nervenzellen besonders häufig benutzt wird. Man nimmt heute an, dass die Leitfähigkeitserhöhung des NMDA-Rezeptors eins der wesentlichen Elemente für die Induktion synaptischer Plastizität ist und damit einen molekularen Mechanismus für Lernen und Gedächtnis darstellt.
Das Modell besagt, dass NMDA-Rezeptoren bestimmter synaptischer Bahnen, die sehr häufig benutzt werden, durch die ständige Depolarisation der postsynaptischen Membran deblockiert werden und somit diese Bahnen besser leitfähig werden als alternative Verschaltungsmuster. Somit werden bestimmte „Wege“ gebahnt, ein wesentlicher Prozess des Lernens. So lässt es sich verstehen, dass eine pathologische Fehlsteuerung der NMDA-Rezeptoren mit der Krankheit Schizophrenie in Verbindung gebracht wird. Auch für die sogenannten Nahtod-Erfahrungen wurde eine Beeinflussung (Blockade) von NMDA-Rezeptoren vermutet, denn NMDA-Antagonisten wie Ketamin oder Phencyclidin können entfernt ähnliche Effekte hervorrufen.
Wirkung von Alkohol auf den NMDA-Rezeptor
Bindet Alkohol (Ethanol) am NMDA-Rezeptor, so wird der Einstrom von Calcium-Ionen vermindert. Somit nimmt die Frequenz exzitatorischer Potentiale ab, Alkohol reduziert folglich die Wirkung des wichtigsten exzitatorischen Systems, wobei gleichzeitig die Funktion des wichtigsten inhibitorischen Systems (GABA) durch die Bindung an den GABA-Rezeptor verstärkt wird. Die alkoholinduzierte Blockade des NMDA-Rezeptors wird unter anderem mit Gedächtnisstörungen nach exzessivem Alkoholkonsum in Verbindung gebracht. Bei übermäßigem oder langfristigem Alkoholkonsum steigt die Zahl der NMDA-Rezeptoren an, wobei gleichzeitig der Calciumeinstrom zunimmt. Diese Gegenregulierung führt beim Alkoholentzug zu Entzugserscheinungen, da es beim Wegfall der Hemmung des NMDA-Rezeptors zu einer Überfunktion des exzitatorischen Systems kommt, was sich in Form von Unruhe, Angst oder Schlaflosigkeit zeigt.
NMDA-Rezeptor-Neurotoxizität (Olneys Läsionen)
Als die Stoffgruppe der NMDA-Rezeptorantagonisten entdeckt wurde, war zuerst kein schädliches Potential bekannt. Erst John W. Olney u. a. zeigten 1989, dass die NMDA-Rezeptorantagonisten Dizocilpin, Phencyclidin, Ketamin und Dextromethorphan, sowohl in oraler als auch intravenöser Applikation, Läsionen im Gehirn von Ratten verursachen. Der amerikanische Dextromethorphan-Forscher William E. White sagte 1998 in seiner DXM-FAQ, er sei überzeugt, dass die NMDA-Rezeptorantagonisten, auch bekannt als Dissoziativa (dissoziative Drogen), Läsionen bei Menschen verursachen. Er widerrief diese Aussage jedoch 2003. Eine magnetresonanztomographische Untersuchung an chronischen Ketaminkonsumenten zeigte Hirnschäden auch bei allen 21 menschlichen Probanden, wobei die Anzahl der Läsionen mit der Dauer des Konsums korrelierte.
Siehe auch
Literatur
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Biochemie. 6. Auflage. Spektrum Akademischer Verlag, Heidelberg 2007, ISBN 978-3-8274-1800-5.
- Donald Voet, Judith G. Voet: Biochemistry. 3. Auflage. John Wiley & Sons, New York 2004, ISBN 0-471-19350-X.
- Bruce Alberts, Alexander Johnson, Peter Walter, Julian Lewis, Martin Raff, Keith Roberts: Molecular Biology of the Cell. 5. Auflage. Taylor & Francis, 2007, ISBN 978-0-8153-4106-2.
Weblinks
- Übersicht zu Struktur und Funktion des NMDA-Rezeptors (Memento vom 16. Oktober 2008 im Internet Archive), Bristol University (engl.)