Ranibizumab
| Ranibizumab | ||
|---|---|---|
| Masse/Länge Primärstruktur | 48,4 kDa
|
|
| Bezeichner | ||
| Externe IDs |
|
|
| Arzneistoffangaben | ||
| ATC-Code | S01LA04 | |
| DrugBank | DB01270 | |
| Wirkstoffklasse | Monoklonaler Antikörper | |
Ranibizumab ist ein Arzneistoff, der zur Behandlung der feuchten (exsudativen) altersbedingten Makuladegeneration (AMD) sowie einer beeinträchtigten Sehschärfe im Zusammenhang mit einem diabetischen Makulaödem oder einem zystoiden Makulaödem als Folge eines Venenastverschlusses (VAV) oder Zentralvenverschlusses (ZVV) in der Retina eingesetzt wird.
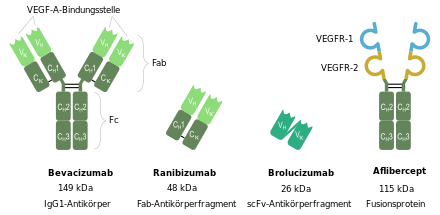
Ranibizumab ist ein humanisiertes, rekombinantes monoklonales Antikörperfragment (Fab) und hemmt den „Vascular Endothelial Growth Factor“ (VEGF-A), ein Protein, das bei der Ausbildung kleiner Blutgefäße (Angiogenese) eine Rolle spielt.
Inhaltsverzeichnis
Klinische Angaben
Anwendung
Ranibizumab wird nach örtlicher Betäubung durch eine intravitreale Injektion in den Glaskörper des Auges verabreicht. Eine genaue Verfolgung des Krankheitsverlaufes und die Entscheidung über eine Weiterführung der Therapie ist mit der modernen optischen Kohärenztomografie möglich. Die AMD ist die häufigste Erblindungsursache im Alter in den Industrieländern.
Eine infolge eines diabetischen Makulaödems eingeschränkte Sehschärfe wird durch monatliche Injektionen solange durchgeführt, bis der maximale Visus erreicht ist.
Die Anwendung des Arzneimittels darf ausschließlich durch einen qualifizierten Augenarzt erfolgen, der über die notwendige Praxis-Infrastruktur zur aseptischen Anwendung verfügt.
Injektionen nach Schema oder nach Bedarf
Bezüglich wiederholter Injektionen nach retinalen Venenverschlüssen sind zwei gegensätzliche Verfahren in Gebrauch, die Schema-Methode oder die Bedarfs-Methode. Bei der Schema-Methode gibt es verschiedene Varianten. Sie haben gemeinsam, dass hier alle Patienten – unabhängig vom Erfolg der ersten Spritze – nach einem Monat eine zweite bekommen und nach einem weiteren Monat eine dritte. Danach wird dann – abhängig vom bisherigen Erfolg – weiter im Monatsrhythmus gespritzt, oder die Intervalle werden schrittweise (etwa um jeweils zwei Wochen) verlängert. Das Schema wird solange fortgesetzt, bis keine Verbesserung mehr zu erwarten ist. Es gibt auch die Variante, dass nach den ersten drei Spritzen nur noch nach Bedarf gespritzt wird. Dagegen wird bei der Bedarfs-Methode, auch genannt 1 + PRN (pro re nata = für die Sache wie entwickelt), bereits nach der ersten Spritze nur noch nach Bedarf gespritzt.
Die Unterschiede der beiden Methoden haben eine erheblich klinische Bedeutung. Da die Heilungsverläufe je nach dem Umfang der anfänglichen Störung und dem Allgemeinzustand des Patienten höchst unterschiedlich sind, gibt es Patienten, bei denen bereits nach einer oder zwei Spritzen der maximale Erfolg dauerhaft erreicht ist. Das bedeutet, dass bei der Bedarfs-Methode im Durchschnitt weniger Spritzen verabreicht werden als bei der Schema-Methode. Die Bedarfs-Methode ist daher wirtschaftlicher (die Kosten einer Injektion betragen ca. 1600 Euro) und auch gesundheitlich weniger belastend für die Patienten.
Wegen dieser Unterschiede wurden mehrere gezielte Vergleichsstudien der beiden Methoden durchgeführt, um festzustellen ob die aufwändigere und teurere Methode tatsächlich die überlegene ist. Es zeigte sich durchweg, dass eine Unterlegenheit der Bedarfs-Methode nicht existiert und die Ergebnisse beider Methoden gleichwertig sind.
In einer Erhebung von 2017 in Japan gaben 28 von 34 befragten Retina-Spezialisten (82,4 %) an, im Falle eines Venenastverschlusses (VAV), unabhängig von der Schwere des Falles, die Bedarfs-Methode anzuwenden. Vergleichbare Erhebungen in anderen Ländern liegen bislang (Stand 2020) noch nicht vor.
Unerwünschte Wirkungen
Die häufigsten unerwünschten Wirkungen bei der Therapie mit Ranibizumab sind Augenprobleme mit Schmerzen, Blutungen, Fremdkörpergefühl, Erhöhung des Augeninnendrucks (Glaukom) oder Mouches volantes (kleine schwarze Punkte, Flecken oder fadenartige Strukturen im Gesichtsfeld) sowie Kopfschmerzen und arterielle Hypertonie. Schwerwiegend, jedoch selten sind Infektionen des Augeninneren, Beschädigung der Netzhaut oder eine Katarakt (grauer Star). Um das Risiko einer Infektion zu verringern, kann der Patient antibiotische Augentropfen eintropfen.
Eigenschaften
Pharmakologische Eigenschaften
Ranibizumab ist ein humanisiertes, rekombinantes, monoklonales Antikörperfragment, welches speziell für die Behandlung der exsudativen, altersbedingten Makuladegeneration entwickelt wurde. Der Arzneistoff wird gegen den humanen vaskulären endothelialen Wachstumsfaktor A (VEGF-A) eingesetzt. Ranibizumab bindet mit hoher Affinität alle Isoformen des VEGF-A. Dieses gilt als Schlüsselmolekül bei der Entstehung der exsudativen AMD.
Die Bindung des VEGF-A durch Ranibizumab verhindert die Aktivierung der Rezeptoren VEGFR-1 und VEGFR-2 auf der Oberfläche der Endothelzellen. Durch seine geringe Größe kann es alle Netzhautschichten durchdringen und gelangt direkt zu den chorioidalen Neovaskularisationen (CNV), welche zu Blutungen neigen. Die Eigenschaften von Ranibizumab als Antikörperfragment reduzieren das Entzündungsrisiko. Da Ranibizumab eine geringe Plasmahalbwertszeit nach intravitrealer Injektion aufweist, bleibt das Risiko systemischer Nebenwirkungen klein.
Strukturelles
Ranibizumab ist das Fab-Fragment des humanisierten monoklonalen Antikörpers Bevacizumab und wird mittels rekombinanter DNA-Technologie in Escherichia coli hergestellt. Es ist nicht glykosyliert. Ranibizumab unterscheidet sich zudem in seiner Aminosäuresequenz vom Bevacizumab-Fab in 6 Aminosäuren, von denen 4 in der murinen VEGF-A-Bindungsstelle lokalisiert sind (HCDR1 und HCDR2).
Sonstige Informationen
Geschichte
Ranibizumab wurde von Genentech, einer Tochterfirma des Schweizer Unternehmens Hoffmann-La Roche, und Novartis entwickelt. Novartis besitzt die weltweiten Vertriebsrechte für Ranibizumab mit der Ausnahme von Nordamerika (USA, Kanada und Mexiko). Für diese Länder besitzt Genentech die Vertriebsrechte. Die Herstellung für alle Vertriebsgebiete erfolgt durch Hoffmann-La Roche. Lucentis wurde im Januar 2007 durch die Europäische Kommission für alle Länder der Europäischen Union zugelassen. Die Zulassung für die USA war bereits im Juni 2006 erfolgt und für die Schweiz im September 2006.
2011 sprach sich der National Health Service aus gesundheitsökonomischen Gründen gegen eine Kostenübernahme der Therapie bei Typ-2-Diabetikern aus. Die Verfügbarkeit für diese Patientengruppe steht infolgedessen im Vereinigten Königreich in Frage.
Ranibizumab versus Bevacizumab
Ranibizumab wurde hauptsächlich aufgrund der Ergebnisse der MARINA- und der ANCHOR-Studien zur Behandlung der AMD zugelassen. Der Preis von 1.950 US$ pro Injektion wurde schon bei der Einführung in den USA im Juni 2006 von vielen Augenärzten als unerhört hoch empfunden. Hochrechnungen ließen Kosten in Höhe von mehreren Milliarden US$ bzw. € jährlich allein aufgrund dieses einen Medikamentes für das Gesundheitssystem möglich erscheinen. Viele Augenärzte wichen deswegen im Rahmen der ärztlichen Therapiefreiheit auf das erheblich billigere, biochemisch sehr ähnliche Bevacizumab (Avastin) aus, das jedoch für dieses Anwendungsgebiet nicht zugelassen war (sogenannter off label use).
Die Herstellerfirma von Bevacizumab, Hoffmann-La Roche, die zum damaligen Zeitpunkt 33 % Novartis gehört, machte jedoch keinerlei Anstrengungen, um eine Zulassung dieses Medikaments für die Behandlung der AMD zu erlangen. Daraufhin wurden auf Initiative von Augenärzten Therapiestudien initiiert, die vergleichend die Wirksamkeit von Ranibizumab versus Bevacizumab ermitteln sollen. In einer ersten direkten, jedoch kleinen Vergleichsstudie gab es keine Hinweise auf eine Überlegenheit gegenüber dem wesentlich preisgünstigeren Bevacizumab. Als skandalös wurde von vielen Beobachtern der Versuch der Firma Genentech in den USA empfunden, den Verkauf von Bevacizumab an Augenärzte zu unterbinden (Genentech vertreibt auch Bevacizumab in den USA). In einem Kompromiss wurde im Dezember 2007 erreicht, dass Bevacizumab unter bestimmten Bedingungen wieder von Augenärzten benutzt werden kann. Die möglichen Haftungsrisiken für Genentech wurden dabei minimiert.
Die größte wissenschaftliche Gesellschaft der deutschen Augenärzte, die Deutsche Ophthalmologische Gesellschaft, betonte in einer Stellungnahme vom 20. September 2007, dass „die Behandlung zum Wohle der Patienten auf den Prinzipien der evidenzbasierten Medizin“ beruhen müsse, weshalb „die Therapie mit einem Medikament erfolgen sollte, dessen Wirksamkeit und Sicherheit in klinischen Studien für diese Indikation geprüft wurde.“ und befürwortete die Durchführung einer entsprechenden Studie, um die Wirksamkeit und Sicherheit von Avastin mit jener von Lucentis direkt zu vergleichen.
2014 wurden neun Studien ausgewertet, bei der die Sicherheit beider Wirkstoffe verglichen wurde. Als Ergebnis kamen die Forscher zum Schluss, dass gegenüber dem teureren Ranibizumab (Lucentis) Bevacizumab (Avastin) gleich wirksam sei und kein erhöhtes Risiko für Todesfälle oder schweren Nebenwirkungen zeige.
Vergleichsstudien
Eine Reihe von klinischen Studien untersuchen vergleichend die Wirksamkeit von Ranibizumab und Bevacizumab bei feuchter Makuladegeneration. Im Mai 2011 wurden im New England Journal of Medicine die Ergebnisse der CATT-Studie veröffentlicht. Als Ergebnis der Studie zeigte sich, dass nach einem Jahr Behandlung die Wirkung der beiden Medikamente praktisch gleich war. Bezüglich der aufgetretenen Nebenwirkungen empfahlen die Autoren weitere wissenschaftliche Untersuchungen. Am 6. Mai 2012 wurde ein Zwischenergebnis der britischen IVAN-Studie publik gemacht, das eine Wirkungsäquivalenz von beiden Substanzen nach 12 Monaten Behandlung ergab. Die Ergebnisse der deutschen VIBERA- und der österreichischen Manta-Vergleichsstudie standen Ende 2012 noch aus.
Der Streit um Bevacizumab bei AMD und die o. g. Studien wird in der Öffentlichkeit mit großem Interesse verfolgt, weil hier wichtige prinzipielle Fragen des off-label-Gebrauchs von Medikamenten zur Sprache kommen.
Studien
- J. Gaudreault, D. Fei, J. Rusit, P. Suboc, V. Shiu: Preclinical pharmacokinetics of Ranibizumab (rhuFabV2) after a single intravitreal administration. In: Invest. Ophthalmol. Vis. Sci. Band 46, Nr. 2, Februar 2005, S. 726–733, doi:10.1167/iovs.04-0601, PMID 15671306.
- I. K. Kim, D. Husain, N. Michaud u. a.: Effect of intravitreal injection of ranibizumab in combination with verteporfin PDT on normal primate retina and choroid. In: Invest. Ophthalmol. Vis. Sci. Band 47, Nr. 1, Januar 2006, S. 357–363, doi:10.1167/iovs.04-0087, PMID 16384985.
- G. Coscas, F. Coscas, G. Soubrane: Traitement par injection intra-vitréenne de Ranibizumab (Lucentis®) pour des néovaisseaux choroïdiens occultes prédominants liés à la DMLA. In: Journal Français d'Ophtalmologie. Band 29, Nr. 7, September 2006, S. 731–737 (em-consulte.com).
- R. H. Guymer: Managing neovascular age-related macular degeneration: a step into the light. In: Med. J. Aust. Band 186, Nr. 6, März 2007, S. 276–277, PMID 17371204 (Online [abgerufen am 21. September 2021]).
- P. Epstein: Trials that matter: two faces of progress in the treatment of age-related macular degeneration. In: Ann. Intern. Med. Band 146, Nr. 7, April 2007, S. 532–534, PMID 17404357.
- T. C. Smith, L. Lee: Age related macular degeneration - new developments in treatment. In: Aust Fam Physician. Band 36, Nr. 5, Mai 2007, S. 359–361, PMID 17492074 (racgp.org.au).
- G. Landa, W. Amde, V. Doshi u. a.: Comparative study of intravitreal bevacizumab (Avastin) versus ranibizumab (Lucentis) in the treatment of neovascular age-related macular degeneration. In: Ophthalmologica. Band 223, Nr. 6, 2009, S. 370–375, doi:10.1159/000227783, PMID 19590252.
- D. S. Fong, P. Custis, J. Howes, J. W. Hsu: Intravitreal bevacizumab and ranibizumab for age-related macular degeneration a multicenter, retrospective study. In: Ophthalmology. Band 117, Nr. 2, Februar 2010, S. 298–302, doi:10.1016/j.ophtha.2009.07.023, PMID 19969368.
- Ranibizumab and Bevacizumab for Neovascular Age-Related Macular Degeneration. In: N Engl J Med. April 2011, doi:10.1056/NEJMoa1102673, PMID 21526923.
- Philip J. Rosenfeld: Bevacizumab versus Ranibizumab for AMD. In: New England Journal of Medicine. 364, 2011, S. 1966–1967, doi:10.1056/NEJMe1103334.
Fertigarzneimittel
Originalpräparat: Lucentis (EU, USA, CA, J)
Biosimilars: Byooviz (EU, USA, CA), Cimerli (USA), Ranovisio (EU)
Weblinks
- Lucentis by FDA (PDF; 611 kB)
- Leitlinie Nr. 21: Altersabhängige Makuladegeneration (PDF; 114 kB) Berufsverband der Augenärzte Deutschlands e.V. (BVA)
- Nicola Kuhrt: Schuss ins Auge. In: Die Zeit. 8. Mai 2008.
- C. Schmucker, C. Ehlken, G. Antes, N. Schmacke, H. J. Agostini, L. Hansen, M. Lelgemann: Evidenzbericht: Therapie der alterabhängigen Makuladegeneration. (PDF; 697 kB), 2009
- Behandlung einer Visusbeeinträchtigung infolge eines diabetischen Makulaödems (DMÖ) (PDF; 88 kB) Information der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ), 25. Juli 2011
- Öffentlicher Beurteilungsbericht (EPAR) der europäischen Arzneimittelagentur (EMA) zu: Ranibizumab