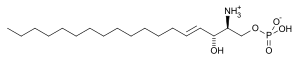
Sphingosin-1-phosphat
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Sphingosin-1-phosphat | ||||||||||||||||||
| Andere Namen |
|
||||||||||||||||||
| Summenformel | C18H38NO5P | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 379,472 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest |
||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Sphingosin-1-phosphat, auch S1P, ist eine in Wirbeltieren, Insekten und Pflanzen vorkommende chemische Verbindung aus der Gruppe der Sphingolipide bzw. Lysophosphatide. Der Phosphorsäureester des Sphingosins ist ein Gewebshormon (Second Messenger) mit Einfluss auf das Zellwachstum, die aktive Ortsveränderung von Zellen (Zellmigration) sowie die Zelldifferenzierung. Sphingosin-1-phosphat hemmt auch die Apoptose (programmierter Zelltod).
Inhaltsverzeichnis
Geschichte
Die Erstbeschreibung von S1P fand im Jahr 1884 durch den deutschen Arzt Ludwig Thudichum statt. Dieser isolierte die Substanz aus dem Gehirn und benannte sie aufgrund ihrer "enigmatischen Natur" nach dem mythologischen Wesen der Sphinx.
Biosynthese und Metabolismus
Die Biosynthese des Sphingosin-1-phosphats erfolgt aus dem Sphingolipid Sphingomyelin. Dieses wird durch die Sphingomyelinase unter Abspaltung eines Phosphocholinrestes zum Ceramid und weiter durch die Ceramidase zum Sphingosin hydrolysiert. Auf letzteres wird durch die Sphingosinkinase (EC 2.7.1.91) unter Verbrauch eines Moleküls ATP ein Phosphatrest auf die Hydroxygruppe übertragen und Sphingosin-1-phosphat freigesetzt.
Der Abbau erfolgt über zwei Wege: Einerseits wird im Umkehrung des letzten Syntheseschrittes S1P zu Sphingosin und Phosphat hydrolysiert, andererseits kann durch die Sphinganin-1-phosphat-Aldolase (EC 4.1.2.27, auch Sphingosin-1-phosphat-Lyase) eine Spaltung in 2-Hexadecenal und Phosphoethanolamin katalysiert werden. Eine Rolle beim Abbau spielen aber auch mehrere Phosphatidat-Phosphatasen.
Funktion
Sphingosin-1-phosphat hat als Signalmolekül vielfältige intra- wie extrazelluläre Funktionen. Besonders hervorzuheben ist seine Bedeutung für:
- die Zellproliferation: S1P steigert die Zellproliferation und ist Schutzfaktor im Falle toxischer Ereignisse. Durch Verringerung von Sphingosin und Ceramid wirkt es anti-apoptotisch.
- die Zellmigration: S1P bewirkt eine Verstärkung des gerichteten Wanderverhaltens einzelner Zellen
- die Gefäßpermeabilität: Durch Aktivierung des VE-Cadherin-Systems/adherens junction und durch unbekannte Effekte auf die vesikuläre Transzytose wird die Durchlässigkeit des Endothels für große Moleküle und ggf. Zellen deutlich reduziert.
- die Angiogenese: Viele Vorgänge der Angiogenese werden unterstützt: Induktion der endothelialen NO-Synthase (eNOS), Proliferation und Migration von Endothelzellen, Röhrenbildung, Gefäßreifung durch glatte Muskelzellen und Perizyten.
- die Funktion von Thrombozyten: S1P wird in den Blutplättchen gebildet, gespeichert und bei Aktivierung sezerniert.
- Stimulation der Cyclooxygenase 2 zur Produktion von PGE2.
Regulation
Vorkommen von S1P
Die Konzentration von S1P innerhalb des Körpers wird durch S1P-Kinasen und -Lyasen streng reguliert. Hohe S1P-Konzentration sind innerhalb von lymphatischen Kapillaren und Blutgefäßen zu finden. Die hauptsächlichen Produzenten von S1P sind dabei Erythrozyten und Endothel-Zellen, wobei auch Thrombozyten einen geringen Anteil haben. Innerhalb des Gewebes wird S1P durch die Wirkung von S1P-Lyasen zügig abgebaut. Dadurch existiert ein steiler Gradient zwischen hohen S1P-Konzentration innerhalb der Gefäße und niedrigen S1P-Konzentrationen des Gewebes. Der resultierende Konzentrationsgradient wird von verschiedenen Zellen zur Migration genutzt.
Positive Regulation
S1P wird durch die Sphingosin-Kinasen (SK1/2) durch Phosphorylierung aus Sphingosin gebildet. Ein Regulationsmechanismus ist die intrazelluläre Konzentration dieses Enzyms am vorausgehenden Ende ("leading edge") der migrierenden Zelle, die Plasmamembran wird durch ihr Phosphatidylserin erkannt. SK1 wird durch verschiedenste Wachstumsfaktoren und Hormone induziert.
Negative Regulation
Der Abbau von S1P erfolgt durch die S1P-Lyase (Coenzym: Pyridoxalphosphat) zu Hexadecanal und Phosphoethanolamin. Daneben sind auch verschiedene andere Lipidphosphatasen in der Lage S1P zu Sphingosin zu dephosphorylieren.
Dynamische Regulation in Marginalzonen B-Zellen
Die Milz besteht anatomisch aus 2 verschiedenen Bereichen: die rote und weiße Pulpa. Während in der roten Pulpa die Mauserung der Erythrozyten stattfindet, ist die weiße Pulpa das lymphatische Kompartiment. Sie ist aus T-Zone (periarterielle Lymphscheide; PALS) und B-Zone (Follikel) aufgebaut. Die Übergangszone zwischen Follikeln und roter Pulpa wird als Marginalzone bezeichnet. Zwischen Marginalzone und Follikeln ist der Marginalsinus lokalisiert. In der Marginalzone sind spezialisierte Marginalzonen B-Zellen (MZB) lokalisiert. Nach Kontakt mit Substanzen die ein pathogen-associated molecular pattern (PAMP) oder damage-associated molecular pattern (DAMP) tragen, wandern diese MZB in den Follikel hinein. Dabei präsentieren sie den follikulären B-Zellen des Follikels die Antigene mit denen sie in Kontakt gekommen sind. Einige Tage nach ihrer Einwanderung verlassen sie den Follikel wieder und sind dann erneut in der Marginalzone zu finden. Dieser Migrationsprozess wird über 2 verschiedene Substanzen reguliert. Die follikulären dendritischen Zellen (fDC) produzieren das Chemokin CXCL13. In der Marginalzone ist auf Grund des hohen Blutanteils eine hohe S1P-Konzentration vorhanden. Im Ruhezustand exprimieren die MZB sowohl S1P1, S1P3 und CXCR5. Sowohl S1P1 wie auch S1P3 bewirken eine Wanderung der Zellen in Richtung der höchsten S1P-Konzentration, also in die Marginalzone. Demgegenüber ist der Ligand von CXCR5 das Chemokin CXCL13, somit bewirkt eine Expression von CXCR5 eine Wanderung der Zellen in den Follikel hinein. Da die S1P-Rezeptoren eine höhere Priorität als der CXCR5-Rezeptor haben überschreiben sie dessen Wirkung. Das Resultat ist, dass die MZB in der Marginalzone verbleibt. Kommt die MZB nun aber in Kontakt mit einem PAMP oder DAMP (z. B. LPS) bewirkt dies den Abbau der S1P-Rezeptoren. Dadurch wird die CXCR5-CXCL13-Wirkung nicht mehr überschrieben und die MZB wandert in den Follikel hinein. Nach einigen Tagen erholt sich die S1PR-Expression und es ist wieder S1P1 und S1P3 an der Zelloberfläche zu finden. Dadurch wird die CXCR5-CXCL13-Wirkung erneut überschrieben und die Zellen wandern zur höchsten S1P-Konzentration, also zurück in die Marginalzone. Dieser Prozess wird als Oszillation der Marginalzonen-B-Zellen beschrieben.
Ein vergleichbarer Prozess wird auch von konventionellen B-Zellen genutzt. Sie nutzen eine verstärkte CXCR5-Expression um in den Follikel einzuwandern. Nachdem sie ihre follikuläre Reifung abgeschlossen haben verlassen sie die B-Zone durch vermehrte S1P1-Expression und erreichen die Marginalzone. Da sie aber weniger Integrine als MZB exprimieren können sie sich dort nicht niederlassen, sondern mit dem Blutfluss weggetragen, dadurch kehren sie in die Zirkulation zurück. Dieser Prozess wird als Rezirkulation bezeichnet.
Rezeptoren
Signaltransduktion
S1P-Rezeptoren sind G-Proteine gekoppelte Rezeptoren und werden durch Ligandenbindung und Autophosphorylierung oder durch ligandenunabhängige Phosphorylierung durch andere Kinasen (z. B. akt/PI3K) aktiviert. Die Rezeptoren wurden zunächst EDG (endothelial differentiation gene), später S1PR (S1P-Rezeptoren) benannt. Die aktuelle Nomenklatur bezeichnet die 5 verschiedenen S1P-Rezeptoren als S1P1-5, wobei die entsprechenden Gene als S1PR1-5 bezeichnet sind. Typische second messenger sind MAPK, PI3K, PLC/IP3/Calcium, Rho-Kinase.
S1P-Rezeptor Typ 1 (S1P1)
Der S1P-Rezeptor Typ 1 (S1P1) beeinflusst die Angiogenese und die Wanderung von Immunzellen durch den Körper. Bei S1P1-Rezeptor Knockout-Mäusen ist die Angiogenese größerer Gefäße defekt, wobei das Verhalten der glatten Muskelzellen und Perizyten so verändert ist, dass sie sich nicht im notwendigen Ausmaß bilden. S1PR1-defiziente (s1pr1–/–) Embryonen versterben noch vor der Geburt auf Grund fehlerhafter Vaskularisierung. Defizienzen in anderen S1P-Rezeptoren sind lebensfähig und werden in wissenschaftlichen Studien zur Erforschung der S1P-Rezeptoren genutzt.
S1P-Rezeptor Typ 2 (S1P2)
S1P2 ist relevant für die Degranulation von Mastzellen, deren Histamin-Sekretion und die Kontraktion von glatten Muskelzellen in Bronchien.
S1P-Rezeptor Typ 3 (S1P3)
Der Rezeptor S1P3 beeinflusst die Migration und Proliferation von verschiedenen Zellen. Außerdem wurde eine Rolle in Entzündungsprozessen, Krebserkrankungen und verschiedenen kardiovaskulären Erkrankungen beschrieben.
S1P-Rezeptor Typ 4 (S1P4)
Die Expression von S1P4 ist wichtig für die regelrechte Bildung von Thrombozyten. Außerdem wurde ein Einfluss auf peritoneale B-Zellen beschrieben.
S1P-Rezeptor Typ 5 (S1P5)
Der S1P5-Rezeptor ist insbesondere auf den Oligodendrozyten des Nervensystems vorhanden und scheint einen Einfluss auf deren Überleben zu haben.
Klinische Anwendung
Verschiedene Medikamente sind zugelassen, die auf einer Beeinflussung des S1P-Systems beruhen. Ihnen gemeinsam ist eine Wirkung über die S1P-Rezeptoren. Bisher sind keine Medikamente zugelassen, welche die Produktion oder den Abbau von S1P direkt beeinflussen. Das erste zugelassene Medikament war Fingolimod (FTY720), dessen Effekt insbesondere der Hemmung des S1P-Rezeptors Typ 1 (S1P1) zugeschrieben wurde. Auch die anderen zugelassenen Medikamente wirken primär über eine Hemmung von S1P1. Im Körper verhindern diese Wirkstoffe eine Auswanderung von B-Zellen aus lymphatischen Organen in den Blutkreislauf. Bei einer Multiplen Sklerose entstehen auto-reaktive B-Zellen. Das bedeutet, dass diese Immunzellen körpereigene Gewebe angreifen, statt Krankheitserreger zu bekämpfen. Im Falle der Multiplen Sklerose greifen die auto-reaktiven B-Zellen das Nervensystem an. Durch Einnahme von Fingolimod und ähnlichen Medikamenten werden die B-Zellen daran gehindert von ihrem Entstehungsorten auszuwandern und sind dadurch nicht mehr in der Lage das Nervensystem zu attackieren. Dies kann zu einer Besserung der Symptome von Patienten führen die unter Multipler Sklerose leiden. Gleichzeitig sind aber auch alle anderen B-Zellen nicht mehr in der Lage in den Blutstrom einzuwandern. Ein typischer Befund ist daher ein Mangel von Immunzellen im Blut, eine sogenannte Lymphopenie.
| Wirkstoff | S1P1 | S1P2 | S1P3 | S1P4 | S1P5 | Indikation |
|---|---|---|---|---|---|---|
| Fingolimod (Gilenya; Hersteller: Novartis) | + | – | + | + | + | Zulassung zur
Behandlung von Multipler Sklerose |
| Ozanimod (Zeposia; Hersteller: BMS) | + | – | – | – | + | |
| Ponesimod (Ponvory; Hersteller: Janssen) | + | – | – | – | – | |
| Siponimod (Mayzent; Hersteller: Novartis) | + | – | – | – | – |
Etrasimod ist ein – noch experimenteller – einmal täglich oral einzunehmender Sphingosin-1-Phosphat-Rezeptor-Modulator, der u. a. in den Indikationen Atopische Dermatitis, Colitis ulcerosa, Eosinophile Ösophagitis und Morbus Crohn untersucht wird.
Literatur
- S. Spiegel, S. Milstien: Sphingosine 1-phosphate, a key cell signaling molecule. In: J. Biol. Chem. Bd. 277, 2002, S. 25851–25854. PMID 12011102, doi:10.1074/jbc.R200007200
- S. Pyne, N. J. Pyne: Sphingosine 1-phosphate signalling in mammalian cells. In: Biochem. J. Bd. 349, 2000, S. 385–402. PMID 10880336; PMC 1221160 (freier Volltext) – ausführlicher, aber schwer zu lesender alter Übersichtsartikel
- T. A. Taha u. a.: Sphingosine kinase: biochemical and cellular regulation and role in disease. In: J. Biochem. Mol. Biol. Bd. 39, 2006, S. 113–131. PMID 16584625 PDF – ausführlicher Review, der auf die SK zentriert, dabei jedoch die gesamte klinische Bedeutung beschreibt
- A. E. Alewijnse u. a.: Cardiovascular effects of sphingosine-1-phosphate and other sphingomyelin metabolites. In: Br J Pharmacol. Bd. 143, 2004, S. 666–684. PMID 15504747
- I. Girkontaite u. a.: The sphingosine-1-phosphate (S1P) lysophospholipid receptor S1P3 regulates MAdCAM-1+ endothelial cells in splenic marginal sinus organization. In: J Exp Med Bd. 200, 2004, S. 1491–1501. PMID 15583019
- K. A. Vora u. a.: Sphingosine 1-phosphate receptor agonist FTY720-phosphate causes marginal zone B cell displacement. In: J Leukoc Biol Bd. 78, 2005, S. 471–480. PMID 15894589
- G. Cinamon u. a.: Sphingosine 1-phosphate receptor 1 promotes B cell localization in the splenic marginal zone. In: Nat Immunol Bd. 5, 2004, S. 713–720. PMID 15184895
- T. Sanchez u. a.: Phosphorylation and action of the immunomodulator FTY720 inhibits vascular endothelial cell growth factor-induced vascular permeability. In: J Biol Chem. Bd. 278, 2003, S. 47281–47290. PMID 12954648
- S. H. Wei u. a.: Sphingosine 1-phosphate type 1 receptor agonism inhibits transendothelial migration of medullary T cells to lymphatic sinuses. In: Nat Immunol. Bd. 6, 2005, S. 1228–1235. PMID 16273098

