Tetranitromethan
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Tetranitromethan | |||||||||||||||
| Andere Namen |
|
|||||||||||||||
| Summenformel | CN4O8 | |||||||||||||||
| Kurzbeschreibung |
farblose, scharf riechende Flüssigkeit |
|||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 196,03 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig |
|||||||||||||||
| Dichte |
1,6229 g·cm−3 |
|||||||||||||||
| Schmelzpunkt |
14 °C |
|||||||||||||||
| Siedepunkt |
126 °C |
|||||||||||||||
| Dampfdruck |
|
|||||||||||||||
| Löslichkeit |
|
|||||||||||||||
| Brechungsindex |
1,4384 |
|||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK |
|
|||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
38,4 kJ/mol |
|||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Tetranitromethan (TNM), C(NO2)4, ist ein Nitroderivat des Methans und damit ein Nitroalkan. Die Verbindung ist der vierfachsubstituierte Vertreter der Reihe der Nitromethane mit Nitromethan, Dinitromethan, Trinitromethan und Tetranitromethan.
Inhaltsverzeichnis
Gewinnung und Darstellung
Tetranitromethan kann in guter Ausbeute durch Nitrierung von Essigsäureanhydrid oder Isopropanol hergestellt werden. Bei einer neueren Methode erhält man die Verbindung durch Einleiten von Keten in 100%ige Salpetersäure. Die Synthesen erfordern eine sehr exakte Einhaltung der Reaktionsbedingungen und sind nicht ungefährlich. Eine Destillation der Verbindung sollte vermieden werden.
Eigenschaften
Physikalische Eigenschaften
Tetranitromethan ist eine farblose bis gelbliche, stechend riechende, extrem stark brandfördernde Flüssigkeit. Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 4,54919, B = 1582,071 und C = −49,74 im Temperaturbereich von 313 K bis 373 K bzw. A = 1,75688, B = 498,772 und C = −158,538 im Temperaturbereich von 273 K bis 313 K. Die molare Verdampfungsenthalpie beträgt 43,1 kJ·mol−1.
Explosionskenngrößen
Wichtige Explosionskennzahlen sind:
- Explosionswärme: 2193 kJ·kg−1(H2O (g)).
- Detonationsgeschwindigkeit: 6360 m·s−1 bei der Dichte von 1,65 g·cm−3
- Normalgasvolumen: 686 l·kg−1.
- Spezifische Energie: 675 kJ·kg−1
- Verpuffungspunkt: 140 °C
- Schlagempfindlichkeit: 19 N·m
Die Verbindung allein ist nur wenig explosiv. Mit Kohlenwasserstoffen werden aber Gemische mit sehr hoher Brisanz gebildet. Gemische mit Treibmitteln sind äußerst schlag- und reibempfindlich. Mittels DSC wurde ab 130 °C eine stark exotherme Zersetzungsreaktion mit einer Zersetzungswärme von −443 kJ·mol−1 bzw. −2260 kJ·kg−1 gemessen.
Toxizität
Die Dämpfe greifen die Atemwege stark an, was bei der hohen Flüchtigkeit der Verbindung beachtet werden muss. Der Stoff hat im Tierversuch krebserregende Wirkung gezeigt, da die DNA von diesem Stoff nitriert wird. Tetranitromethan ist nach Anhang II, Nr. 6 der deutschen Gefahrstoffverordnung (GefStoffV) als besonders gefährlicher krebserzeugender Stoff eingestuft und darf nur in geschlossenen Anlagen hergestellt oder verwendet werden.
Struktur
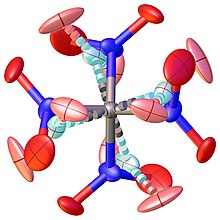
Tetranitromethan ist ein Paradebeispiel für molekulare Flexibilität. Es brachte strukturelle Methoden an die Grenzen ihrer Anwendbarkeit, wie die Tatsache zeigt, dass über einen Zeitraum von mehr als 70 Jahren in verschiedenen Phasen versucht wurde, die Struktur von TNM zu bestimmen.
Frühe Untersuchungen mittels Gaselektronenbeugung konnten das beobachtete Beugungsmuster nicht vollständig beschreiben und erst die Anwendung eines vierdimensionalen Modells über die korrelierte Bewegung der vier NO2-Gruppen um die C-N-Bindungen konnte die experimentellen Beobachtungen vollständig beschreiben. Das Problem tritt auf, weil die zweifache lokale Symmetrie der C-NO2-Einheiten gegenüber der dreifachen Symmetrie der C(NO2)3-Einheit sowie die enge Nachbarschaft der NO2-Gruppen, die ihre freie Rotation behindert, die Ursache für eine sehr komplizierte, gegenseitig behinderte Bewegung der NO2-Gruppen ist.
Auch an der Kristallstruktur wurde bereits mehrfach gearbeitet. Eine erste anständige Lösung des Problems erforderte ein Modell, das eine stark fehlgeordnete kristalline Hochtemperaturphase (>174,4 K) beschreibt, wie sie in Abbildung 1 dargestellt ist. Die Reduktion der Symmetrie und die Analyse der Verzwillingung der Kristalle führte schließlich zu einer aufgelösten Fehlordnung der in Abbildung 2 dargestellten Struktur.
Die Struktur der geordneten Tieftemperaturphase enthält drei unabhängige Moleküle in der asymmetrischen Einheit. Die Strukturparameter der gasförmigen und festen Phase sind in der folgenden Tabelle zum Vergleich aufgeführt.
Verwendung und Handhabung
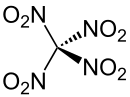
Eine in der Chemie wichtige Verwendung beruht auf der Fähigkeit des Tetranitromethans, olefinische Doppelbindungen anzuzeigen. Wie bei der Strukturformel zu erkennen ist, befindet sich das Kohlenstoffatom in einem Elektronenmangelzentrum, das mit Doppelbindungen Charge-Transfer-Komplexe bildet, die an einer starken Gelbfärbung zu erkennen sind. Diese Tatsache wird in der Analyse als Indikator für Doppelbindungen verwendet.
Tetranitromethan kann als Bestandteil von flüssigen Sprengstoffen mit großer Brisanz als Oxidationsmittel benutzt werden. Es bildet mit allen brennbaren Stoffen hochexplosive Gemische. Bei Experimenten mit diesem Stoff darf zum Filtrieren kein Papier verwendet werden. Schon geringe Verunreinigungen machen aus Tetranitromethan einen Explosivstoff, der bei Schlag oder Reibung explodiert. Bekannt ist ein tragischer Vorlesungsversuch an der Universität Münster im Jahre 1920, wo eine kleine Stahlröhre, in der sich Tetranitromethan, Toluol und Watte befanden, kurz vor dem Ausbrennen so detonierte, dass über 30 Studenten teils schwer verletzt wurden. Aufgrund der Rektoratsakten sind jedoch sogar zehn Tote und mehr als ein Dutzend Verletzte belegt. Daraufhin ermittelte die chemisch-technische Reichsanstalt eine Detonationsgeschwindigkeit von 9300 Metern pro Sekunde. Alfred Stettbacher wies dann vergleichend nach, dass diese Mischung weitaus brisanter als Hexogen, Pentrit, Sprenggelatine oder Panclastit war und so den zerstörungsgewaltigsten Sprengstoff überhaupt darstellt.
In der organischen Synthesechemie kann es als Nitrierungsmittel verwendet werden, insbesondere unter basischen Reaktionsbedingungen. Dabei wird allerdings nur eine Nitrogruppe zur Nitrierung genutzt, das mesomeriestabilisierte Trinitromethidion (Trinitromethan, Trivialname Nitroform) wirkt nicht mehr nitrierend.