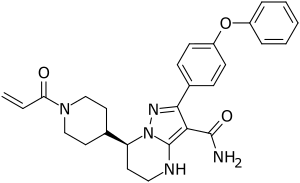
Zanubrutinib
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Zanubrutinib | |||||||||||||||
| Andere Namen |
|
|||||||||||||||
| Summenformel | C27H29N5O3 | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| ATC-Code | ||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 471,561 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest |
|||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Zanubrutinib (Handelsname Brukinsa; Hersteller BeiGene) ist ein Arzneistoff, der zur Behandlung erwachsener Patienten mit Morbus Waldenström (MW), Marginalzonenlymphom (MZL) und chronische lymphatische Leukämie (CLL) eingesetzt wird. Bei Zanubrutinib handelt es sich um einen Bruton-Tyrosinkinase-Inhibitor (BTKi) aus der Gruppe der Tyrosinkinase-Inhibitoren.
Brukinsa ist sowohl in den USA durch die FDA als auch in Europa durch die EMA in verschiedenen Indikationen zugelassen. In verschiedenen weiteren Ländern (unter anderem Australien, Brasilien, China, Kanada etc.) sind auch weitere Indikationen zugelassen beziehungsweise im Zulassungsverfahren, z. B. Mantelzelllymphom (MCL).
Inhaltsverzeichnis
Klinische Angaben
Anwendungsgebiete
Eine Brukinsa-Monotherapie wird angewendet zur Behandlung erwachsener Patienten mit Morbus Waldenström (MW), die mindestens eine vorherige Therapie erhalten haben, oder zur Erstlinientherapie bei Patienten, die für eine Chemo-Immuntherapie nicht geeignet sind. Zanubrutinib wird ebenfalls angewendet zur Behandlung erwachsener Patienten mit rezidiviertem/refraktärem Marginalzonen-Lymphom (MZL), die zuvor mindestens eine Anti-CD20-basierte Therapie erhalten haben. Außerdem ist Zanubrutinib für die Behandlung erwachsener Patienten mit therapie-naiver (TN) oder rezidivierter/refraktärer (R/R) chronischer lymphatischer Leukämie (CLL) zugelassen.
Art und Dauer der Anwendung
Brukinsa ist zum Einnehmen bestimmt. Die empfohlene Gesamttagesdosis von Zanubrutinib beträgt 320 mg.
Wechselwirkungen mit anderen Medikamenten
Zanubrutinib wird hauptsächlich durch das Cytochrom-P450-Enzym 3A (CYP3A) metabolisiert. Die gleichzeitige Anwendung von Brukinsa und Arzneimitteln, die CYP3A stark oder mäßig hemmen, kann die Zanubrutinib-Exposition erhöhen. Dazu zählen Antibiotika zur Behandlung bakterieller Infektionen, Arzneimittel zur Behandlung von Pilzinfektionen und / oder Arzneimittel zur Behandlung einer HIV-Infektion, z. B. Posaconazol, Voriconazol, Ketoconazol, Itraconazol, Clarithromycin, Indinavir, Lopinavir, Ritonavir und / oder Telaprevir. Ebenso kann es zu Wechselwirkungen mit Grapefruits und Bitterorangen kommen, die mäßige CYP3A4-Inhibitoren als natürliche Inhaltsstoffe enthalten.
Anwendung während Schwangerschaft und Stillzeit
Frauen müssen während der Anwendung von Brukinsa und bis zu einem Monat nach Behandlungsende eine Schwangerschaft vermeiden.
Unerwünschte Wirkungen
Die häufigsten Nebenwirkungen (≥ 20 %) waren Neutropenie (56,2 %), Thrombozytopenie (45,1 %), Infektion der oberen Atemwege (44,3 %), Blutungen/Hämatome (32,2 %), Hautausschlag (29,8 %), Blutergüsse (29,1 %) Anämie (28,9 %), Schmerzen des Muskel- und Skelettsystems (24,3 %), Durchfall (23,6 %), Pneumonie (22,1 %) und Husten (21,7 %).
Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden.
Pharmakologische Eigenschaften
Wirkungsmechanismus
Zanubrutinib ist ein Bruton-Tyrosinkinase(BTK)-Inhibitor. Zanubrutinib bildet eine kovalente Bindung mit einem Cysteinrest im aktiven Zentrum der BTK, was zu einer Hemmung der BTK-Aktivität führt. BTK ist ein Signalmolekül im Signalweg des B-Zell-Antigen-Rezeptors (BCR) und des Zytokin-Rezeptors. In B-Zellen führt die BTK-Signalübertragung zur Aktivierung von Signalwegen, die für die Proliferation, Migration, Chemotaxis und Adhäsion von B-Zellen notwendig sind.
Zulassungsstatus
Die EU-Kommission hat die Zulassung für Europa im November 2021 erteilt. Das CHMP der EMA empfahl die Zulassung für die EU im September 2021. Zanubrutinib wurde ursprünglich im Mai 2019 für die Behandlung des lymphoplasmozytischen Lymphoms als Arzneimittel für seltene Leiden (Orphan Drug) ausgewiesen, jedoch von der Europäischen Kommission im Oktober 2021 auf Antrag des Zulassungsinhabers zum Zeitpunkt der Erteilung der Zulassung aus dem Unionsregister für Arzneimittel für seltene Leiden gestrichen. Ein Orphan-Status besteht für die Behandlung des Marginalzonenlymphoms. Die Zulassung in den USA erfolgte im August 2021. In den USA bestehen Einstufungen und Zulassungen als Orphan-Arzneimittel in verschiedenen Anwendungsgebieten.
In verschiedenen Ländern sind bereits weitere Indikationen zugelassen, z. B.
- Mantelzelllymphom (MCL) (USA, November 2019 und China, Juni 2020 und andere Länder).
Handelsnamen
Zanubrutinib wird unter dem Namen Brukinsa als Monopräparat von BeiGene hergestellt und vertrieben.
Literatur
- Constantine S. Tam, Stephen Opat, Shirley D'Sa, Wojciech Jurczak, Hui-Peng Lee, Gavin Cull, Roger G. Owen, Paula Marlton, Björn E. Wahlin, Ramón Garcia Sanz, Helen McCarthy, Stephen Mulligan, Alessandra Tedeschi, Jorge J. Castillo, Jaroslaw Czyz, Carlos Fernández de Larrea, David Belada, Edward Libby, Jeffrey V. Matous, Marina Motta, Tanya Siddiqi, Monica Tani, Marek Trneny, Monique C. Minnema, Christian Buske, Veronique Leblond, Judith Trotman, Wai Y. Chan, Jingjing Schneider, Sunhee Ro, Aileen Cohen, Jane Huang, Meletios Dimopoulos, for the ASPEN Investigators: A randomized phase 3 trial of zanubrutinib vs ibrutinib in symptomatic Waldenström macroglobulinemia: the ASPEN study. In: Blood. Band 136, Nr. 18, 2020, S. 2038–2050, doi:10.1182/blood.2020006844, PMID 32731259.
