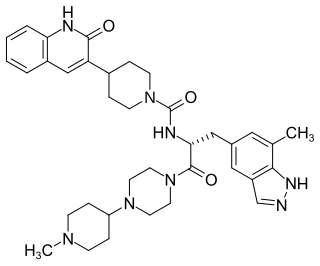
Zavegepant
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Zavegepant | |||||||||||||||
| Andere Namen |
|
|||||||||||||||
| Summenformel | C36H46N8O3 | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||
| Wirkmechanismus |
Hemmung des CGRP-Rezeptors |
|||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 638,80 g·mol−1 | |||||||||||||||
| pKS-Wert |
4,8 und 8,8 |
|||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Zavegepant ist ein Arzneistoff aus der Wirkstoffklasse der niedermolekularen CGRP-Rezeptor-Antagonisten (Gepante). Unter dem Namen Zavzpret (Pfizer) wurde er im März 2023 in den USA zugelassen zur akuten Behandlung der Migräne mit und ohne Aura bei Erwachsenen.
Zavegepant wird als Nasenspray verabreicht. Es ist der erste CGRP-Rezeptor-Antagonist zur nasalen Anwendung.
Inhaltsverzeichnis
Eigenschaften
Zavegepant wird pharmazeutisch in Form seines Salzsäuresalzes (1:1), Zavegepanthydrochlorid, eingesetzt. Zavegepanthydrochlorid ist ein weißes bis fast weißes Pulver und leicht löslich in Wasser. Die pKs-Werte betragen 4,8 und 8,8, die molare Masse ist 675,28 g·mol−1.
Wirkungsmechanismus
Gepante sind niedermolekulare CGRP-Rezeptor-Antagonisten. CGRP steht für Calcitonin Gene-Related Peptide, ein Neuropeptid, das an der Auslösung von Migräneanfällen beteiligt ist.
Zavegepant blockiert den CGRP-Rezeptor und hebt dadurch die Effekte von CGRP auf.
Klinische Prüfung
Die Zulassung basiert auf zwei randomisierten, doppelblinden, placebokontrollierten Studien (Studie 1 und Studie 2) mit insgesamt circa 2000 Teilnehmern, in denen Zavegepant gegen Placebo untersucht wurde.
Ein Endpunkt in beiden Studien war die Schmerzfreiheit nach zwei Stunden, die jeweils in der Verum-Gruppe signifikant häufiger erreicht wurde als in der Placebo-Gruppe (Studie 1: 23,6 vs. 14,9 Prozent, Studie 2: 22,5 vs. 15,5 Prozent). Hinsichtlich der Beseitigung von den am meisten störenden Symptomen (Lichtempfindlichkeit, Übelkeit, Lärmempfindlichkeit) zwei Stunden nach der Einnahme war Zavegepant gegenüber Placebo ebenfalls statistisch überlegen. Auch bei weiteren Endpunkten (Schmerzlinderung nach 2 Stunden, Rückkehr zur normalen Funktion nach 2 Stunden, anhaltende Schmerzfreiheit innerhalb 2 bis 48 Stunden nach Nasenspray-Anwendung) zeigte Zavegepant eine bessere Wirksamkeit im Vergleich zu Placebo.
Die häufigsten unerwünschten Wirkungen, die bei mehr als 2 Prozent der Patienten und häufiger als bei Placebo berichtet wurden, waren Geschmacksstörungen, Übelkeit, nasale Beschwerden und Erbrechen.
Handelsnamen
Zavzpret (USA)
