Pinene
Pinene (Betonung auf der zweiten Silbe: Pinen) sind Monoterpen-Kohlenwasserstoffe, farblose Flüssigkeiten mit der Summenformel C10H16. Pinene sind Bestandteile ätherischer Öle.
Inhaltsverzeichnis
Vertreter

Bekannt sind sechs Pinen-Isomere, je zwei Enantiomere von α-Pinen und β-Pinen sowie zwei Isomere von δ-Pinen, in der Literatur als (+)-cis-δ-Pinen und (−)-cis-δ-Pinen beschrieben.
1907 wurden von Otto Wallach drei Pinene als α, β- und γ-Pinen zugeordnet. 1921 wurde ein weiterer Vertreter entdeckt und folglich als δ-Pinen bezeichnet. Die von Wallach zugeordnete Konstitution von „γ-Pinen“ wurde 1947 durch Harry Schmidt wieder verworfen, da sie der Bredtschen Regel widerspricht. Die genannten klassischen Bezeichnungen der Pinene (α, β, γ, δ) wurden trotzdem beibehalten, da sie sich bereits zu jener Zeit in der Literatur eingebürgert hatten.
| Pinene | ||||||||||||||||||
| Name | (+)-α-Pinen | (−)-α-Pinen | (+)-β-Pinen | (−)-β-Pinen | (+)-cis-δ-Pinen | (−)-cis-δ-Pinen | ||||||||||||
| Andere Namen | Pin-2(3)-en 2-Pinen 2,6,6-Trimethylbicyclo- [3.1.1]hept-2-en |
Pin-2(10)-en 2(10)-Pinen Nopinen Pseudopinen 6,6-Dimethyl-2-methylenbicyclo- [3.1.1]heptan |
||||||||||||||||
| Pinen, DIDEHYDROPINANE (INCI) | ||||||||||||||||||
| Strukturformel |

|
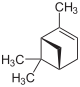
|

|

|

|

|
||||||||||||
| CAS-Nummer | 7785-70-8 | 7785-26-4 | 19902-08-0 | 18172-67-3 | ||||||||||||||
| 80-56-8 (unspezifiziert) | 127-91-3 (unspezifiziert) | |||||||||||||||||
| 1330-16-1 (Isomerengemisch) | ||||||||||||||||||
| PubChem | 82227 | 440968 | 10290825 | 440967 | 12314302 | |||||||||||||
| Summenformel | C10H16 | |||||||||||||||||
| Molare Masse | 136,24 g·mol−1 | |||||||||||||||||
| Aggregatzustand | flüssig | |||||||||||||||||
| Kurzbeschreibung | farblose Flüssigkeit mit terpentinartigem Geruch | |||||||||||||||||
| Schmelzpunkt | −55 °C | −61 °C | ||||||||||||||||
| Siedepunkt | 155 °C | 165–166 °C | ||||||||||||||||
| Dichte | 0,86 g·cm−3 (15 °C) | 0,87 g·cm−3 (20 °C) | ||||||||||||||||
| Dampfdruck | 5 hPa (25 °C) | 2,66 hPa | ||||||||||||||||
| Löslichkeit | praktisch unlöslich in Wasser | |||||||||||||||||
| Brechungsindex | 1,4653 (20 °C) | 1,4768 (20 °C) | ||||||||||||||||
| Flammpunkt | 33 °C | 36 °C | ||||||||||||||||
|
GHS- Kennzeichnung |
|
|
|
|
|
|||||||||||||
| H- und P-Sätze | 226‐304‐315‐317‐410 | 226‐315‐319‐335 | 226‐304‐315‐317‐410 | siehe oben | siehe oben | |||||||||||||
| keine EUH-Sätze | keine EUH-Sätze | keine EUH-Sätze | siehe oben | siehe oben | ||||||||||||||
| 210‐273‐280‐301+310‐303+361+353‐331 | 310‐302+352‐305+351+338 | 210‐273‐280‐301+310+331‐302+352 | siehe oben | siehe oben | ||||||||||||||
Vorkommen
Die α- und β-Pinene kommen in zahlreichen Pflanzen unter anderem in Kiefern, wie Pinus kesiya,Pinus gerardiana,Sumpf-Kiefer (Pinus palustris),Waldkiefer (Pinus sylvestris) und Pinus roxburghii , in Eukalyptusarten, wie Eucalyptus grandis, und dem Blauem Eukalyptus (Eucalyptus globulus),, in Myrte (Myrtus communis),Fichtennadeln, Dill (Anethum graveolens),Wacholder (Juniperus communis),Schwarzer Pfeffer ( Piper nigrum),Fenchel (Foeniculum vulgare),Petersilie (Petroselinum crispum),Boswellia sacra,Guave (Psidium guajava),Koriander (Coriandrum sativum),Rosmarin (Rosmarinus officinalis),Muskatnuss (Myristica fragrans),Sellerie (Apium graveolens),Kreuzkümmel (Cuminum cyminum),Sternanis,Moschus-Erdbeeren,Wermutkraut und Kümmel (Carum carvi) vor. δ-Pinen zum Beispiel in Rosmarin.
Vor allem aus Kiefern (lat. pinus) wird Balsam gewonnen, aus dem Terpentinöl destilliert wird, das mehrere Pinene enthält (etwa 60 Prozent α-Pinen). Daraus hergestellte Produkten wie Farben, Ölen und Wachsen enthalten ebenfalls Pinene.
Verwendung
Aus Pinen können Sandalore, Citronellal, Campher, Linalool und Myrcen synthetisiert werden.
Biosynthese
α-Pinen und β-Pinen werden beide aus Geranylpyrophosphat durch Cyclisierung von Linalool-pyrophosphat gefolgt durch Umlagerung eines Wasserstoffatoms synthetisiert.
Eigenschaften
Pinene sind wenig flüchtige, entzündliche, klare Flüssigkeiten mit terpentinartigem Geruch, weniger dicht als Wasser, und in Wasser unlöslich. Ihre Schmelz- und Siedetemperaturen sowie ihre Dichten unterscheiden sich nur geringfügig. α-Pinen oxidiert üblicherweise zu Verbenon, Myrtenol, Pinenoxid und weiteren Produkten. Durch Einwirkung von Hitze kann β-Pinen in Myrcen umgewandelt werden. Ein sekundäres Oxidationsprodukt von Pinen ist das allergieauslösende Ascaridol, weshalb ätherische Öle, die Pinen enthalten, schon nach wenigen Tagen Allergien auslösen können.
α-Pinen gehört zu den Monoterpenen und wird als Aromastoff in der Lebensmittelindustrie verwendet.
α-Pinen in höheren Dosen wird durch seine Reizwirkung auf Augen, Atemwege und Haut, und mögliche neuro- und nephrotoxische Wirkungen als gesundheitsschädlich eingestuft. Auch β-Pinen wirkt reizend. α-Pinen wirkt möglicherweise antientzündlich und zumindest in vitro antimikrobiell. In niedrigen Dosen wirkt α-Pinen bronchospasmolytisch.
Analytik
Zur zuverlässigen qualitativen und quantitativen Bestimmung kommt nach angemessener Probenvorbereitung die Kopplung von Gaschromatographie und Massenspektrometrie zum Einsatz. Auch die Anwendung der Olfaktometrie wird zur Identifizierung und Charakterisierung herangezogen.
Risikobewertung
Pin-2(10)-en wurde 2014 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Pin-2(10)-en waren die Besorgnisse bezüglich Verbraucherverwendung, hoher (aggregierter) Tonnage und weit verbreiteter Verwendung sowie der vermuteten Gefahren durch sensibilisierende Eigenschaften. Die Neubewertung fand ab 2014 statt und wurde von Griechenland durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht.
Verwandte Verbindungen
Literatur
- Dennis Hobuß: α- und β-Pinen: Vielseitige chirale Kohlenstoffgerüste für die asymmetrische Katalyse. WiKu-Wissenschaftsverlag Dr. Stein, Duisburg/ Köln 2007, ISBN 978-3-86553-225-1.
















