2,2,2-Trifluorethanol
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | 2,2,2-Trifluorethanol | |||||||||||||||||||||
| Andere Namen |
|
|||||||||||||||||||||
| Summenformel | C2H3F3O | |||||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit charakteristischem Geruch |
|||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 100,04 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig |
|||||||||||||||||||||
| Dichte | ||||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt | ||||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| pKS-Wert |
12,4 |
|||||||||||||||||||||
| Löslichkeit |
löslich in Wasser, löslich in Alkoholen, Ketonen, Estern, Ethern, mischbar mit niedrigen aliphatischen und aromatischen Kohlenwasserstoffen, mit Chloroform und 1,1,1-Trichlorethan |
|||||||||||||||||||||
| Brechungsindex |
1,2907 (20 °C) |
|||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Treibhauspotential |
24 (bezogen auf 100 Jahre) |
|||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
2,2,2-Trifluorethanol (Trifluorethanol, TFE) ist eine fluororganische Verbindung mit der Konstitutionsformel CF3-CH2OH. Die hohe Elektronegativität der Trifluormethylgruppe ist verantwortlich für den im Vergleich zu Ethanol stärker ausgeprägten Säurecharakter von Trifluorethanol, das sich in vielen Reaktionen phenolartig verhält. Das elektrische Dipolmoment (2,03 Debye), der hohe Wert des Polaritätsparameters ET(30) von 250,2 kJ·mol−1 und die ausgeprägte Neigung zur Ausbildung von Wasserstoffbrücken machen TFE zu einem ausgezeichneten protischen Lösungsmittel für polare Verbindungen.
Inhaltsverzeichnis
Darstellung
2,2,2-Trifluorethanol kann verhältnismäßig aufwändig durch katalytische Hydrierung von Trifluoressigsäure, und deren Derivaten, wie z. B. Trifluoracetylchlorid, oder 2,2,2-Trifluorethyltrifluoracetat, erhalten werden.
Von industriellem Interesse ist die Route ausgehend von 2-Chlor-1,1,1-trifluorethan, einem Zwischenprodukt der Halothan-Synthese. Der Prozess kann entweder diskontinuierlich und zweistufig über die Bildung eines TFE-Esters
oder kontinuierlich und einstufig in Gegenwart von Wasser zum 2,2,2-Trifluorethanol geführt werden.
Bei dem kontinuierlichen Verfahren in einem Schlaufenreaktor wird 2-Chlor-1,1,1-trifluorethan (durch Anlagerung von Fluorwasserstoff an Trichlorethen in der Gasphase) mit wässriger Kaliumacetat-Lösung unter Druck bei Temperaturen über 250 °C und Verweilzeiten von ca. einer Stunde bei 77-prozentigem Umsatz mit einer Ausbeute von bis zu 95 % zu TFE hydrolysiert.
In einer Prozessvariante wird 2-Chlor-1,1,1-trifluorethan mit dem Kaliumsalz der γ-Hydroxybuttersäure (aus γ-Butyrolacton und Kalilauge) in γ-Butyrolacton als Lösungsmittel unter Bildung von Kaliumchlorid und γ-Butyrolacton zur Reaktion gebracht.
Der Prozess soll sich durch extreme Produktreinheit, milde Reaktionsbedingungen und fehlenden Produktionsabfall (das KCl kann als Dünger verwendet werden) auszeichnen.
Eigenschaften
2,2,2-Trifluorethanol ist eine klare, farblose Flüssigkeit von ethanolartigem Geruch, die mit Wasser und vielen polaren Lösungsmitteln in jedem Verhältnis mischbar ist. Seine Dichte ist höher als die von Dichlormethan. Trifluorethanol ist bis 315 °C thermisch stabil und spaltet oberhalb der Zersetzungstemperatur Fluorwasserstoff ab. Mit seinem Flammpunkt von 33 °C ist TFE als brennbare Flüssigkeit klassifiziert, nicht leicht bioabbaubar und kann schwere Augen- und Fertilitätsschäden verursachen.
Verwendung
TFE eignet sich als ausgezeichnetes Lösungsmittel für eine Vielzahl organischer Verbindungen, aufgrund seines niedrigen Treibhauspotentials als Reinigungsflüssigkeit, z. B. für elektronische Bauteile als Ersatz für Fluorchlorkohlenwasserstoffe, als Eluent in der HPLC, sowie als Arbeitsmedium im so genannten Organic Rankine Cycle zur Rückgewinnung von Abwärme.
Wegen seiner hohen Ionisierungsenergie und niedrigen spezifischen Leitfähigkeit wird TFE als Lösungsmittel für ionische Reaktionen und konduktometrische Titrationen verwendet.
Bemerkenswert ist das außerordentlich hohe Lösevermögen von TFE für polare Polymere, wie z. B. Polyamide (Nylon), Polymethylmethacrylat, Polyvinylacetat, Polyacrylnitril und Celluloseacetat, wobei Nylonkonzentrationen bis 10 % erreicht und die TFE-Lösungen zur Bestimmung der Molmassenverteilung eingesetzt werden können. Die gute Löslichkeit von Polyamiden in TFE kann auch zum Zusammenfügen fester Nylonoberflächen oder zur Herstellung von nylonverstärkten Klebstoffen genutzt werden.
Wie Polyamide löst TFE auch Peptide und Proteine, häufig unter Denaturierung.
TFE eignet sich ebenfalls als Lösungsmittel für Polymerisationen, die z. B. durch Palladium- oder Ruthenium-Komplexe katalysiert werden.
Aus 2,2,2-Trifluorethanol ist 2,2,2-Trifluoracetaldehyd durch elektrochemische Oxidation als Trifluorethyl-Halbacetal oder durch Gasphasenoxidation in Gegenwart von Wasser an Vanadin-Molybdän-Mischkontakten bei 260 °C als Acetal zugänglich.
2,2,2-Trifluorethanol liefert die Molekülbausteine CF3CH2 (Trifluorethylgruppe) und CF3CH2O (Trifluorethoxygruppe) für chemische Synthesen, z. B. können die Halogenatome in dihalogensubstituierten Benzoesäuren in einer Art Ullmann-Reaktion durch Trifluorethoxyreste substituiert werden.
Die entstehende 2,5-Bis(2,2,2-trifluorethoxy)benzoesäure ist ein Baustein für das Antiarrhythmikum Flecainid.
Der Protonenpumpenhemmer Lansoprazol enthält eine Trifluorethoxygruppe im Pyridin-Molekülteil, die z. B. durch Ersatz einer Nitrogruppe im Zwischenprodukt 2-Cyano-3-methyl-4-nitropyridin entsteht.
Auch das Herbizid Triflusulfuron-methyl enthält eine über TFE eingeführte Trifluorethoxygruppe.
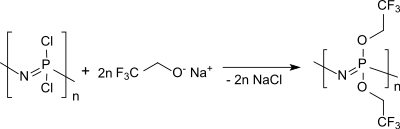
Beim polymeranalogen Austausch der Chloratome im Polydichlorphosphazen durch TFE (als Natriumsalz) entsteht Poly[bis(trifluorethoxy)phosphazen], ein Standard-Polyphosphazen, das als hydrophobes Elastomer Folien, Fasern und Membranen bildet.
Die Ester von 2,2,2-Trifluorethanol mit Acrylsäure oder Methacrylsäure stellen Monomere dar, die mit einer Vielzahl anderer Monomere copolymerisiert werden können und die erhaltenen Copolymeren wasserabweisend, sauerstoffdurchlässig und hochtransparent werden lassen. Diese Eigenschaften macht man sich bei der Herstellung weicher Kontaktlinsen zunutze.
Die wichtigste Anwendung für 2,2,2-Trifluorethanol ist die Herstellung des Inhalationsnarkotikums Isofluran und seines Derivats Desfluran.
In einer neueren Verfahrensvariante wird Isofluran in zwei Stufen unter Verwendung des als Kältemittel weitgehend verbotenen Chlordifluormethans (Freon 22, R22) erhalten.
Desfluran entsteht durch Austausch des Chloratoms durch Fluor mit Fluorwasserstoff in Gegenwart von Antimonpentafluorid auf Aktivkohle bei 135 °C.