Anämie
| Klassifikation nach ICD-10 | |
|---|---|
| D50–D53 | Alimentäre Anämien |
| D55–D59 | Hämolytische Anämien |
| D60–D64 | Aplastische und sonstige Anämien |
| ICD-10 online (WHO-Version 2019) | |
Eine Anämie (lateinisch Anaemia, deutsch Blutarmut, umgangssprachlich auch Blutmangel, früher auch Bleichsucht) ist eine Verminderung der Hämoglobin-Konzentration im Blut (oder alternativ des Hämatokrits) unter die alters- und geschlechtsspezifische Norm.
Hämoglobin ist ein Sauerstoff-tragendes Protein, das sich im Blut ganz überwiegend in den roten Blutzellen (Erythrozyten) befindet. Eine Anämie geht daher in der Regel mit einem Mangel an Erythrozyten (Erythrozytopenie) einher. Bei einer Anämie ist die Sauerstoff-Transportkapazität des Blutes vermindert. Um die Sauerstoffversorgung der Organe weiter zu gewährleisten, reagiert der Organismus typischerweise mit einer Steigerung der Herzfrequenz, so dass das Blut schneller durch den Kreislauf gepumpt wird. Dadurch gerät der Körper aber leichter an seine Belastungsgrenzen. Typische Symptome einer Anämie sind daher leichte Ermüdbarkeit, Luftnot besonders bei körperlicher Belastung und häufig auch Kopfschmerzen.
Eine Anämie ist entweder erworben oder angeboren. Ursachen für erworbene Anämien können Blutverluste, ein vermehrter Blutabbau, Erkrankungen des blutbildenden Systems, Mangelerkrankungen, Nierenerkrankungen, Hormonstörungen, Schwangerschaft oder „konsumierende Erkrankungen“ wie Tumorerkrankungen oder chronisch-entzündliche Erkrankungen sein. Angeborene Anämien kommen z. B. bei Hämoglobinopathien (genetischen Störungen der Hämoglobinbildung) vor.
Inhaltsverzeichnis
Etymologie
Der Begriff Anämie, lateinisch als anaemia 1843 von dem französischen Mediziner Gabriel Andral geprägt, stammt aus dem Altgriechischen ἄναιμος ánaimos „blutlos“ und setzt sich zusammen aus der Vorsilbe αν- an- „un-“, „ohne“, „nicht“ und dem Wort αἷμα haíma „Blut“.
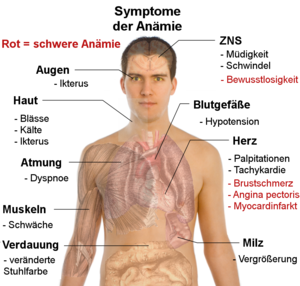
Symptome
Die bei einer Anämie auftretenden Symptome sind entweder eine direkte Folge der Sauerstoffunterversorgung oder der Kompensationsmechanismen des Körpers. Patienten merken infolge der mangelhaften Sauerstoffversorgung des ganzen Körpers als erste Symptome häufig eine Körperschwäche, eine Dyspnoe, einen Leistungsabfall und eine schnelle Ermüdbarkeit.
Haut und Schleimhäute sind durch Blässe gekennzeichnet, wobei zumindest die Hautblässe abhängig von der Hautfarbe nicht immer leicht erkennbar ist. An den Skleren kann in manchen Fällen eine weißliche Farbe mit bläulichem Unterton festgestellt werden, bedingt durch Blutarmut kleinster konjunktivaler Gefäße. Durch eine Sauerstoffunterversorgung des Gehirns können Kopfschmerzen, Ohrgeräusche (Tinnitus), Übelkeit, Ohnmacht (Synkopen), Schlaflosigkeit, Konzentrationsprobleme und Sehstörungen auftreten. Eine Sauerstoffunterversorgung des Herzmuskels führt zu Angina Pectoris. Infolge einer Sauerstoffunterversorgung kann es in den Nieren zu einem geringfügigen Ausscheiden von Blut im Urin (mikroskopische Hämaturie), einer leichten Eiweißausscheidung (Proteinurie) und einem Rückhalt von Salz und Wasser (Niereninsuffizienz) kommen. Weiterhin können bei länger anhaltender Anämie brüchige Finger- und Fußnägel, Haarausfall und Spliss beobachtet werden.
Da der Körper versucht, den Sauerstoffbedarf der Gewebe trotz der verminderten Sauerstofftransportkapazität des Blutes zu decken, können eine beschleunigte Atmung (Tachypnoe) und ein erhöhter Herzschlag (Tachykardie) auftreten.
Aufgrund der erhöhten Frequenz des Blutumlaufs und damit auch der erhöhten Strömungsgeschwindigkeit des Blutes kann es zu charakteristischen Geräuschen in den Jugularvenen am Hals kommen, dem sogenannten Nonnensausen, sowie zu anämischen Strömungsgeräuschen an den Herzklappen, die mit dem Stethoskop wahrnehmbar sind, ohne dass ein struktureller Herzklappenfehler besteht.
Neben diesen allgemeinen Symptomen kann es je nach Anämieform noch zu weiteren Krankheitsbildern kommen. Eine Anämie ist jedoch immer Symptom einer Grunderkrankung oder einer Fehlernährung, sie kann nie eine vollständige Diagnose sein. Trotzdem sollten schon kleine Anzeichen der Anämie ernst genommen werden, da diese auf lange Zeit zu einer erhöhten Sterblichkeit, vor allem durch Herz-Kreislauf-Erkrankungen, führen können.
Diagnostik
| Bezeichnung | Frauen | Männer |
|---|---|---|
| Hämoglobin | 12 bis 16 g/dl | 14 bis 18 g/dl |
| Erythrozyten | 4,3 bis 5,2 Mio./μl | 4,8 bis 5,9 Mio./μl |
| MCH | 28–34 pg | |
| MCHC | 30–36 g/dl | |
| MCV | 78–94 fl | |
| Retikulozyten | 1 % | |
| Hämatokrit | 37–47 % | 40–54 % |
| Ferritin | 22–112 µg/l | 34–310 µg/l |
| Transferrin | 212–360 mg/dl | |
| Vitamin B12 | >300 ng/l | |
| Folsäure | >2,5 ng/ml | |
Eine Verdachtsdiagnose kann sich bereits aus der Krankengeschichte (Anamnese) und dem allgemeinen körperlichen Befund ergeben. Im Rahmen einer weiteren Ursachenabklärung stehen insbesondere die Suche nach Blutungsquellen (besonders Blutungen aus Magen und Darm sowie genitale Blutungen bei Frauen) sowie Hämolysezeichen und ein abgestuftes System von Laboruntersuchungen zur Verfügung.
Dabei ist es wichtig zu unterscheiden, ob es sich bei einer Anämie um eine durch einen vermehrten Blutverlust/-abbau oder aber um eine durch eine Blutbildungsstörung bedingte Blutarmut handelt. Es können auch Mischformen vorkommen. Das wichtigste technische Hilfsmittel für die Diagnose einer Anämie ist das Blutbild.
Die erste Information, die ein Blutbild liefert, ist die, ob überhaupt eine Anämie vorliegt. Es kann dabei, durch Bestimmung von Hämatokrit und Erythrozytenzahl, eine Verminderung der Zellen im Blut anzeigen. Die Werte zum mittleren Volumen (mittleres Erythrozyteneinzelvolumen, MCV von engl. mean corpuscular volume) der Erythrozyten und die Erythrozytenverteilungsbreite geben Aufschluss über die Größe der Zellen (und damit Hinweis auf die Ursache, siehe Abschnitt Einteilung). Die Hämoglobinkonzentration im Blut sowie der Hämoglobingehalt (mittleres korpuskuläres Hämoglobin, MCH) und die Hämoglobinkonzentration (mittlere korpuskuläre Hämoglobinkonzentration, MCHC) der Erythrozyten bieten mögliche Hinweise auf Störungen in der Bildung des roten Blutfarbstoffs.
Häufig ist die Anämie Zeichen einer systemischen Erkrankung (zum Beispiel Infektionen oder Tumoren) oder das Leitsymptom einer Störung der Erythropoese (Bildung roter Blutkörperchen).
Beispiele aus der Diagnostik:
- Anhand der Anzahl der Retikulozyten (unreife rote Blutkörperchen) lässt sich feststellen, ob eine Blutbildungsstörung vorliegt, da diese unter normalen Umständen bei einem Verlust an roten Blutkörperchen in erhöhter Anzahl vom Knochenmark freigesetzt werden.
- Die Konzentration der am Eisenstoffwechsel beteiligten Proteine wie Ferritin, Transferrin und Transferrinrezeptor gibt Aufschluss über das Vorhandensein einer Eisenmangelanämie oder aber über einen Mangel an Vitamin B12 und an Folsäure bei einer megaloblastären oder bei einer perniziösen Anämie.
- Auch Formabweichungen der roten Blutkörperchen können Aufschluss über bestimmte Anämien geben (zum Beispiel Sichelzellenanämie).
- Ein Knochenmarksausstrich kann zeigen, ob die Ursache im blutbildenden Gewebe im Knochenmark selbst liegt.
Hämoglobin-Gehalt
Die auch heute weitgehend anerkannten Kriterien für die Diagnose von Anämien beruhen auf einem Bericht einer WHO-Expertengruppe aus dem Jahr 1968. Demnach liegt eine Anämie vor, wenn der Hämoglobin-Gehalt folgende Werte unterschreitet:
| Personenkategorie | Hb-Untergrenze (g/dl) |
|---|---|
| Kinder von 6 Monaten bis 6 Jahren | 11 |
| Kinder von 6 bis 14 Jahren | 12 |
| Erwachsene Männer | 13 |
| Erwachsene Frauen, nicht schwanger | 12 |
| Erwachsene Frauen, schwanger | 11 |
Diese Werte wurden aufgrund von neueren Erkenntnissen und größeren Bezugsstichproben angepasst. Neuere Studien in den USA beobachten Unterschiede zwischen physiologischen Hämoglobin-Werten weißer und schwarzer Bevölkerung.
| Quelle | Männer Hb-Untergrenze (g/dl) |
Frauen Hb-Untergrenze (g/dl) |
|---|---|---|
| WHO 1968 | 13 | 12 |
| Jandl 1996 | 14,3 | 12,3 |
| Williams (Beutler et al.) 2001 | 14,0 | 12,3 |
| Wintrobe (Lee et al.) 1998 | 13,2 | 11,6 |
| Rapaport 1987 | 14 | 12 |
| Goyette 1997 | 13,2 | 11,7 |
| Tietz 1995 | 13,2 | 11,7 |
| Hoffman u. a. 2004 | 13,5 | 12,0 |
Einteilung
Anämien lassen sich wie folgt einteilen:
- nach der Morphologie in mikro-, makro- oder normozytäre Anämien (MCV)
- nach dem Hämoglobin-Gehalt in normo-, hypo- oder hyperchrome Anämien (MCH)
- nach der Erythropoese in hypo-, normo- oder hyperregenerative Anämien
- in akute oder chronische Anämien
- in angeborene oder erworbene Anämien
Aregenerative Anämie
Abhängig vom Erscheinungsbild der verbleibenden Erythrozyten werden Anämien in der Klinik in drei Gruppen eingeteilt. Betrachtet werden dabei die Größe der Zellen und der Hämoglobingehalt. Bei normal erscheinenden Zellen spricht man von normochromer, normozytärer Anämie, ist der Hämoglobingehalt vermindert, von hypochromer, mikrozytärer Anämie, ist er erhöht, von hyperchromer, makrozytärer Anämie.
Normochrome, normozytäre Anämie
Während die Zahl der roten Blutkörperchen und damit die Sauerstofftransportkapazität des Blutes reduziert sind, erscheinen die Zellen morphologisch normal. Bei hypoproliferativen Anämien werden infolge eines Mangels oder infolge nicht ausreichender Reaktion auf das Hormon Erythropoetin und auf Zytokine mit vergleichbarer Wirkung (besonders Interleukin-6 und Interleukin-8) nicht ausreichend neue Erythrozyten produziert, um den Bedarf zu decken. Ursache sind entweder Nierenerkrankungen, da dort Erythropoetin synthetisiert wird (renale Anämie), oder Erkrankungen, die einen hypometabolischen Zustand (niedrigen Stoffwechselzustand) des Patienten verursachen. Dies betrifft insbesondere Schilddrüsenunterfunktion, Hypophyseninsuffizienz oder Eiweißmangel.
Ist die Anzahl der Vorläuferzellen der roten Blutkörperchen verringert, so können ebenso nicht ausreichend neue Zellen in den Kreislauf abgegeben werden. Bei diesen Erkrankungen ist die Konzentration von Erythropoetin im Blut zumeist normal. Aplastische Anämien resultieren aus einem Verlust der Stammzellen. Die Ursache dafür ist häufig unbekannt. Aplastische Anämien sind sehr selten, in Europa treten jährlich 0,2 Fälle/100.000 Einwohner auf, gehäuft während Adoleszenz, Schwangerschaft und im Alter. Manchmal finden sich Chromosomenveränderungen als Ursache (Fanconi-Anämie). Ebenso beschädigen Strahlung, Chemikalien, Infektionen, manche Medikamente und ein (die Anaemia splenica verursachender) Hypersplenismus das Knochenmark und haben so indirekt eine Anämie zur Folge. Diese Beschädigungen sind jedoch unspezifisch und betreffen auch die Vorläuferzellen der anderen Blutbestandteile. Bei Tumorerkrankungen kommt es häufig zu einer normochromen, normozytären Anämie, deren Ausmaß durch eine Chemotherapie verstärkt werden kann. Man spricht auch von einer chemotherapieassoziierten Anämie. Je nach Ausgangsbefund und Chemotherapieschema ist die Anämie normozytär oder geringgradig makrozytär typischerweise mit Retikulopenie als Folge des Erythropoeseschadens. Sind ausschließlich die Vorläufer der Erythrozyten betroffen, spricht man von Erythroblastopenie oder PRCA (von engl. Pure Red Cell Aplasia). Ursache für eine chronische PRCA sind Virusinfekte, chronische PRCA können angeboren oder erworben (durch Erkrankungen der Hämolyse, Thymome, Immunreaktionen oder bei chronischer lymphatischer Leukämie) sein. Schließlich geht beim myelodysplastischen Syndrom die Blutbildung nicht von gesunden, sondern von genetisch veränderten Ursprungszellen aus. Auch dies führt zu Anämie.
Bei der Osteomyelofibrose wird das blutbildende Gewebe im Knochenmark nach und nach durch Bindegewebe ersetzt, so dass keine normale Erythropoese stattfinden kann. Andere Ursachen für eine Degeneration des Knochenmarks sind bestimmte Malignome, Infiltration durch Metastasen, maligne Lymphome oder Leukämien.
Hyperchrome makrozytäre Anämie
Diese wird auch als megaloblastäre Anämie bezeichnet. Infolge von Vitamin-B12-, Thiamin- oder Folsäuremangel ist die Produktion roter Blutkörperchen eingeschränkt. Am häufigsten tritt diese, mit einer jährlichen Inzidenz von 9 Fällen/100.000 Einwohner, infolge von Vitamin-B12-Mangel auf.
Bei Kindern aufgrund eines Vitamin-C-Mangels wurde diese Anämieform als Zuelzer-Ogden-Syndrom bezeichnet.
Vitamin B12 (Cobalamin) wird im Körper bei der DNS-Synthese benötigt. Da nicht genügend DNS für die Zellteilung verfügbar ist, bleibt es bei im Vergleich zu reifen Erythrozyten vergrößerten Zellen (Megaloblasten). Der Mangel an Vitamin B12 kann verschiedene Ursachen haben:
- Nicht ausreichende Aufnahme mit den Nahrungsmitteln (v. a. bei veganer Ernährung, also vollständigem Verzicht auf Lebensmittel tierischen Ursprungs)
-
Malabsorption:
- Für die Aufnahme von Vitamin B12 in die Darmschleimhaut muss dieses mit dem sog. intrinsischen Faktor (IF) gebunden werden. Ist dieser nicht oder nicht ausreichend vorhanden, kann Vitamin B12 nicht absorbiert werden. Die Ursache hierfür kann entweder genetisch oder erworben sein. Erworbene Ursachen sind entweder Gastrektomien (operative Entfernung des Magens) oder Autoimmunerkrankungen (dieses Krankheitsbild wird als perniziöse Anämie bezeichnet). Eine weitere mögliche Ursache für Malabsorption ist die Hemmung der Bindung von IF an Cobalamin oder die Bindung des Komplexes aus den beiden an Rezeptoren im Ileum (Krummdarm). Ursache hierfür sind ebenso Autoimmunerkrankungen.
- Erkrankungen des Ileums können ebenso die Aufnahme von Cobalamin hemmen. Hierzu gehören die Zöliakie, Enteritis, Intestinale Tuberkulose und Resektionen des Ileums, aber auch chronisch-entzündliche Darmerkrankungen wie Morbus Crohn und Colitis ulcerosa.
- Bandwurmbefall kann auch einen Vitamin-B12-Mangel auslösen, da die Bandwürmer größere Mengen Vitamin B12 benötigen.
- Enterale Fehlbesiedelung, d. h. eine falsche Zusammensetzung der Darmflora
- Mangel von Transcobalamin II, dem Transportprotein für Vitamin B12 im Blut
- Während der Schwangerschaft, in der Kindheit, bei bösartigen Tumorerkrankungen und bei erhöhter Hämatopoese ist der Bedarf an Vitamin B12 erhöht. Wird dieser gesteigerte Bedarf nicht mit entsprechend vermehrter Aufnahme durch die Nahrung gedeckt, kann es ebenso zu Mangelerscheinungen kommen.
- Cadmiumvergiftung
Folsäure (genauer Tetrahydrofolsäure) wirkt als Coenzym bei der Synthese von Purinen, Thymin und Methionin. Bei einem Mangel kommt es auch zur Störung der DNS-Synthese. Mögliche Ursachen:
- Nicht ausreichende Aufnahme
- Malabsorption infolge von Zöliakie, Medikamenten (Barbiturate, Phenytoin), Alkohol
- Störungen des Metabolismus infolge von Dihydrofolatreduktasemangel oder -hemmung
- Zytotoxische Medikamente, die die DNS-Synthese hemmen
- Erhöhter Bedarf während der Schwangerschaft, in der Kindheit, bei bösartigen Tumorerkrankungen und bei erhöhter Hämatopoese.
Hypochrome, mikrozytäre Anämie
Mikrozytäre Anämien treten zumeist infolge von Eisenmangel oder bei Problemen mit der Nutzung des Eisens im Körper auf.
Die Eisenmangelanämie ist mit einem Anteil von 80 % bei weitem die häufigste Form der Anämie. In Europa leiden etwa 10 %, in den Entwicklungsländern mehr als 50 % der Frauen im gebärfähigen Alter darunter. Allgemein sind 80 % der Patienten weiblich. Ursache ist zumeist ein erhöhter Verlust an Eisen durch erkannte (zum Beispiel bei Unfällen oder während einer Menstruation) oder unerkannte Blutungen, zum Beispiel im Verdauungstrakt, oder durch eine erhöhte intravaskuläre Hämolyse (s. a. Abschnitt zur hämolytischen Anämie). Weitere mögliche Ursachen sind eine mangelhafte Absorption infolge von Durchfall, bei einem Magensäuremangel oder nach einer Gastrektomie, eine nicht ausreichende Aufnahme mit der Nahrung oder ein erhöhter Bedarf im Entwicklungsalter, bei Schwangerschaften oder während der Menstruation. Im Knochenmark ist die Anzahl unreifer Normoblasten (Vorläuferzellen der Erythrozyten) erhöht.
Wenn das Eisen nicht von seinen Speicherorten zu den Orten der Blutbildung im Knochenmark gelangen kann, kann dies ebenso eine Anämie zur Folge haben. Ursachen sind entweder genetische Defizite oder Defekte des Eisentransportproteins Transferrin oder ein Proteinverlust in den Nieren beim nephrotischen Syndrom. Eine mangelhafte Eisennutzung tritt zudem entweder bei Hämoglobinopathien, wie z. B. bei einer Thalassämie oder bei einer Sichelzellenanämie, oder aber bei Aufbaustörungen der Häm-Gruppe wie bei den Porphyrien auf.
Bei einer erworbenen, angeborenen oder idiopathischen Verwertungsstörung von Eisen kommt es zur Einlagerung von Eisen in Erythroblasten (so genannte Sideroblasten, sideroblastische oder sideroachrestische Anämie), im Monozyten-Makrophagen-System und in parenchymatösen Organen wie der Leber bei gleichzeitig meist erhöhtem Serumeisen. Parallel ist die Anzahl der Blutplättchen und der weißen Blutkörperchen häufig ebenfalls vermindert.
Chronische Erkrankungen wie Krebs, Autoimmunerkrankungen (Systemischer Lupus erythematodes oder Rheumatoide Arthritis) sowie akute und chronische Infektionen können ebenso Anämien verursachen. Die Freisetzung von Zytokinen durch aktivierte T-Lymphozyten und Makrophagen (Fresszellen) regt die vermehrte Einlagerung von Eisen in Zellen des retikuloendothelialen Systems an; das Eisen steht dann anderswo nicht mehr zur Verfügung. Außerdem hemmen Zytokine direkt die Erythropoese. Im Falle von bösartigen Tumorerkrankungen spricht man dann von Tumoranämie.
Regenerative Anämie
Regenerative Anämien können unterschieden werden in solche, die nach akuten oder chronischen Blutungen auftreten (Blutungsanämien) und mit einem hohen Blutverlust einhergehen, und solche, die aus einer abnormal hohen Zerstörung der Erythrozyten resultieren (hämolytische Anämie).
Blutungsanämie
Die natürliche Wiederherstellung der normalen Anzahl roter Blutkörperchen bei Anämien nach plötzlichen, starken (akuten) Blutungen kann in drei Phasen unterteilt werden. Direkt nach der Blutung ist die Zahl roter Blutkörperchen normal, da durch die Ausschüttung von Katecholaminen (Adrenalin und Noradrenalin) rote Blutkörperchen aus Reservoirs (hauptsächlich aus der Milz) mobilisiert werden (hämodynamische Kompensation). In der zweiten Phase, der plasmatischen Kompensation, wenige Stunden später, wird, um den Blutdruck aufrechtzuerhalten, das Renin-Angiotensin-Aldosteron-System aktiviert und Vasopressin ausgeschüttet. Durch die folgende Zurückhaltung von Wasser und den Einstrom von Gewebsflüssigkeit kommt es zur Verdünnung des Blutes und damit zur Reduzierung von Hämatokrit und relativer Anzahl roter Blutkörperchen, und letztendlich zur normochromen, normozytären Anämie (akute Blutungsanämie). Die zelluläre Kompensation beginnt mit der Ausschüttung von Erythropoeitin infolge der Gewebshypoxie. Dies regt die Bildung neuer Erythrozyten an und verursacht außerdem eine erhöhte Anzahl von Retikulozyten im Blut, da diese vermehrt und vorzeitig aus dem Knochenmark freigelassen werden. Bis zu einem vollständig normalen Blutbild können sechs bis acht Wochen vergehen, abhängig von der Menge des verlorenen Blutes und der Menge des im Körper gespeicherten Eisens.
Chronische Blutungen (im Verdauungstrakt, gynäkologische Blutungen, hämorrhagische Diathese) führen zumeist zu Eisenmangelanämien.
Hämolytische Anämie
Anämien infolge erhöhter Zerstörung der Erythrozyten werden als hämolytische Anämien bezeichnet. Man unterscheidet zwischen korpuskulären hämolytischen Anämien, bei denen die Ursache in den Erythrozyten liegt, und extrakorpuskulären hämolytischen Anämien, bei denen die Erythrozyten von außen zerstört werden. Durch die Zerstörung der Erythrozyten werden die im Inneren der Zellen befindlichen Stoffe freigesetzt. Deshalb steigen die Plasmaspiegel von Kalium, Lactatdehydrogenase, freiem (ungebundenem) Hämoglobin, unkonjugiertem Bilirubin und Eisen. Auch die Sättigung von Transferrin mit Eisen nimmt zu, was zu einer Reduzierung der Eisenbindefähigkeit des Körpers führt. Außerdem nehmen die Plasmaspiegel von Haptoglobin und Hämopexin ab. Der erhöhte Bilirubingehalt führt zu pleiochromem (dunklem) Stuhl und eventuell zu einem Ikterus (Gelbsucht). Der Urobilinogengehalt des Urins ist erhöht, eine Hämoglobinurie und eventuell auch eine Proteinurie können beobachtet werden.
Behandlung
Die Behandlung von Anämien zielt zuvorderst darauf ab, die Ursachen zu beseitigen.
Bei Patienten, die nicht menstruieren, sind Eisenmangelanämien infolge mangelhafter Eisenaufnahme durch die Nahrung selten. Deswegen müssen bei diesen Patienten Blutungen im Verdauungstrakt als mögliche Ursache der Anämie ausgeschlossen werden. Das benötigte Eisen wird zumeist oral, in seltenen Fällen (entzündliche Magen-Darm-Erkrankungen, Malabsorption, schlechte Verträglichkeit der oralen Gabe) auch parenteral als Injektion verabreicht.
Megaloblastäre Anämien werden durch Beseitigung der Ursachen (etwa Behandlung der Bandwurmerkrankung) und parenterale Gabe von Vitamin B12 oder Vitamin B6 behandelt.
Liegt die Ursache in einer nicht ausreichenden Blutbildung durch genetisch bedingte Defekte, kann eine Knochenmarksspende Heilung oder Linderung versprechen.
Allgemein gilt, dass eine langsam (etwa über Monate) entstandene Anämie vom Patienten besser toleriert wird als eine, die durch eine massive Blutung innerhalb von Stunden entsteht, da der Körper sich an den lang anhaltenden Hämoglobinmangel anpasst. Akute Blutungen werden durch Transfusion von Erythrozyten-Konzentraten behandelt. Genaue Richtwerte, ab denen eine Transfusion notwendig ist, existieren nicht. Stattdessen müssen neben Blutwerten Dauer, Schwere und Ursache der Anämie sowie Vorgeschichte, Alter und klinischer Zustand des Patienten in Betracht gezogen werden. Der Blutspendedienst des DRK gibt als Richtwerte für die Notwendigkeit einer Bluttransfusion ein Abfallen des Hämatokrits infolge von akutem Blutverlust auf Werte unter 30 % bei schwerkranken Patienten mit Herz-Kreislauf-Erkrankungen beziehungsweise auf Werte unter 20 % bei organgesunden, belastbaren Patienten an. Bei weniger stark ausgeprägtem Abfall genügt die Volumensubstitution mit Infusionen. Langfristige Nachteile regelmäßiger Transfusionen sind potentielle Infektionsrisiken, Immunisierung sowie eine Eisenüberladung.
Weiterhin stehen zur Anregung der Blutbildung Antianämika, die eine ähnliche Wirkung wie Erythropoetin aufweisen, zur Verfügung. Erythropoetin ist ein Glykoprotein-Hormon, das als Wachstumsfaktor für die Bildung roter Blutkörperchen (Erythrozyten) während der Blutbildung (Hämatopoese) von Bedeutung ist. Als Therapeutikum wird biotechnologisch hergestelltes Erythropoetin, wie etwa Epoetin alpha, vorwiegend bei der Behandlung der Blutarmut von Dialysepatienten, bei denen die Blutbildung infolge eines Nierenversagens gestört ist, und nach aggressiven Chemotherapiezyklen eingesetzt.
Siehe auch
Literatur
- Tinsley R. Harrison u. a.: Harrison’s Principles of Internal Medicine. Mcgraw-Hill Professional, 2005, ISBN 0-07-007272-8.
- M. Wick u. a.: Eisenstoffwechsel, Anämien. Diagnostik und Therapie. Neue Konzepte bei Renaler Anämie und Rheumatoider Arthritis. Springer Verlag, Wien 2002, ISBN 3-211-83802-3.
- G. Beutel u. a.: Anämie auf einen Blick. Thieme Verlag, Stuttgart 2003, ISBN 3-13-137881-6.
- Bruno de Benoist, Erin McLean, Ines Egli, Mary Cogswell (Hrsg.): Worldwide prevalence of anaemia 1993–2005: WHO global database on anaemia. (PDF, 51S, 687 kB) World Health Organization, 2008, ISBN 978-92-4-159665-7.
- Irmgard Müller: Anämie. In: Werner E. Gerabek u. a. (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin / New York 2005, ISBN 3-11-015714-4, S. 53.
- Ludwig Heilmeyer, Herbert Begemann: Blut und Blutkrankheiten. In: Ludwig Heilmeyer (Hrsg.): Lehrbuch der Inneren Medizin. Springer-Verlag, Berlin/Göttingen/Heidelberg 1955; 2. Auflage ebenda 1961, S. 376–449, hier: S. 395–416 (Anämien).
Weblinks
- Anämiediagramm. Uni-Heidelberg
- Anämiediagnostik im Kindesalter. Leitlinien zur Diagnostik und Therapie in der Pädiatrischen Onkologie und Hämatologie
- Aplastische Anämie. (PDF; 744 kB) Leitlinien zur Diagnostik und Therapie in der Pädiatrischen Onkologie und Hämatologie
- Leitlinien zur Diagnostik und Therapie in der Pädiatrischen Onkologie und Hämatologie: Sichelzellerkrankung
- Thalassämie. Leitlinien zur Diagnostik und Therapie in der Pädiatrischen Onkologie und Hämatologie
- Sideroblastic anemia. OrphaNet