
Altern

| Übergeordnet |
| Prozess in der Entwicklungsbiologie |
| Untergeordnet |
| Zellalterung Organalterung Altern multizellulärer Organismen |
| Gene Ontology |
|---|
| QuickGO |

Das Altern ist ein fortschreitender biologischer Prozess der meisten mehrzelligen Organismen, der graduell zum Verlust der gesunden Körper- und Organfunktionen und schließlich zum biologischen Tod führt. Altern ist der bei weitem wichtigste Risikofaktor für diverse Krankheiten wie Krebs, koronare Herzkrankheit, Alzheimer-Krankheit, Parkinson-Krankheit und chronisches Nierenversagen. Die maximale Lebenszeit, die ein Individuum erreichen kann, wird durch das Altern maßgeblich beschränkt.
Altern ist als physiologischer Vorgang ein elementarer Bestandteil des Lebens aller höheren Organismen und eines der am wenigsten verstandenen Phänomene der Biologie. Allgemein ist die Annahme akzeptiert, dass eine Reihe verschiedener hochkomplexer, vielfach noch ungeklärter Mechanismen für das Altern verantwortlich sind. Sie beeinflussen und begrenzen die Lebensdauer von biologischen Systemen wie Zellen, den daraus aufgebauten Organen, Geweben und Organismen. Auf die Frage, warum Organismen altern, gibt es eine Vielzahl unterschiedlichster Antworten (Alternstheorien), aber bis heute keine wissenschaftlich akzeptierte umfassende Antwort.
Die Gerontologie, auch Alters- und Alternswissenschaft genannt, ist die Wissenschaft vom menschlichen Leben im hohen Alter und vom Altern der Menschen. Die biologische Grundlagendisziplin – ohne Fokussierung auf die Spezies Mensch – ist die Biogerontologie.
Inhaltsverzeichnis
- 1 Definition und Abgrenzungen
- 2 Vom Altern nicht betroffene Organismen
- 3 Modellorganismen der Alternsforschung
- 4 Biomarker für das Altern
- 5 Pathologie des Alterns
- 6 Genetische Einflüsse
- 7 Alternstheorien
- 8 Geschlechtsunterschiede beim Altern
- 9 Alternspsychologie
- 10 Maßnahmen gegen das Altern
- 11 Das Altern aus medizingeschichtlicher Sicht
- 12 Weiterführende Literatur
- 13 Weblinks
- 14 Fußnoten
- 15 Einzelnachweise
Definition und Abgrenzungen


(1) Altern bei Progerie (vorzeitiger Vergreisung)
(2) Beschleunigtes Altern durch Risikofaktoren wie Bluthochdruck, Tabakrauchen, u. ä.
(2A) Nach Akutereignis, beispielsweise einem Schlaganfall, ohne therapeutische Maßnahmen
(2B) Im Fall einer therapeutischen Maßnahme nach einem Akutereignis kann eine Besserung der Vitalität und der Lebenserwartung erzielt werden.
(3) Eine schnelle Funktionsbeeinträchtigung mit einer langen Phase der Behinderung und Pflegeabhängigkeit, wie sie im Fall von Demenz typisch ist
(4) Ein Beispiel für „normales“ Altern mit nur geringen Beeinträchtigungen auch im hohen Alter
(5) Ein idealtypischer Alternsverlauf
Für das Altern selbst gibt es keine allgemein akzeptierte wissenschaftliche Definition. Eine weiter gefasste neuere Definition sieht jede im Laufe des Lebens eines Organismus stattfindende zeitgebundene Veränderung als Altern an. Darunter fallen sowohl die als „positiv“ bewerteten Reifungsprozesse in der Kindheit als auch die negativ gesehenen degenerativen Erscheinungen bei alten Erwachsenen. Aus dieser Definition abgeleitet beginnt das Altern höherer Organismen unmittelbar nach der Vereinigung von Samenzelle und Eizelle und führt zu seinem Tod. Andere Gerontologen definieren das Altern nur über die negativen zeitlichen Veränderungen eines Organismus, beispielsweise den Funktionsverlust von Organen oder die Vergreisung (Seneszenz) nach dem Erwachsenwerden (Adoleszenz). Der deutsche Mediziner und Begründer der Gerontologie, Max Bürger, definierte 1960 das Altern als eine irreversible zeitabhängige Veränderung von Strukturen und Funktionen lebendiger Systeme. Die Gesamtheit der körperlichen und geistigen Veränderungen von der Keimzelle bis zum Tod wird nach Bürger Biomorphose genannt. Welche Veränderungen man dabei dem Altern zuordnet, lässt allerdings viel Spielraum für Interpretationen. Der US-amerikanische Gerontologe Leonard Hayflick definiert Altern als die Summe aller Veränderungen, die in einem Organismus während seines Lebens auftreten und zu einem Funktionsverlust von Zellen, Geweben, Organen und schließlich zum Tod führen. Für Bernard L. Strehler wird das Altern eines mehrzelligen Organismus durch drei Bedingungen definiert:
- Universalität: Die Prozesse des Alterns sind bei allen Individuen einer Art mit der gleichen Gesetzmäßigkeit vorhanden.
- Systemimmanenz: Altern ist eine Erscheinungsform des Lebens. Die Prozesse des Alterns laufen auch ohne exogene Faktoren ab.
- Irreversibilität: Das Altern läuft stets nur in eine Richtung. Die sich dabei vollziehenden Veränderungen sind irreversibel.
Über diese naturwissenschaftlichen Definitionen hinaus ist das Altern beim Menschen ein sozial komplexes vieldimensionales Durchlaufen der Lebensspanne von Geburt bis Tod. Die genetische Disposition und die biologischen Veränderungen sind das zentrale Element der komplexen Wechselwirkung zwischen Mensch und Umwelt. Die Vorgänge beim Altern unterliegen subjektiven, biologischen, biographischen, sozialen und kulturellen Bewertungen. Das Altern selbst ist ein Phänomen mit sowohl biologischen als auch psychischen und gesellschaftlichen Aspekten.
Im allgemeinen Sprachgebrauch wird Altern weitgehend mit negativen Veränderungen, mit Verfall, Verschlechterung und Degeneration der sensorischen und körperlichen Fähigkeiten assoziiert. Diese Veränderungen werden besser mit der Bezeichnung Seneszenz wiedergegeben. Die Bezeichnung Alterung sollte nur für unbelebte Materie verwendet werden.
Mit dem Begriff Alter sind meistens die Lebensperiode älterer Menschen, die der „Alten“, und das Ergebnis des Altwerdens gemeint. Im Gegensatz dazu geht es beim Altern vor allem um die Prozesse und Mechanismen, die zum Alter führen und die dem Altwerden und dem Altsein zugrunde liegen.
- Siehe auch: Alter als Lebensabschnitt des Menschen am Lebensende, insbesondere auch das Altersbild.
Primäres und sekundäres Altern
Beim Altwerden wird zwischen zwei Formen unterschieden, dem primären und dem sekundären Altern.
- Primäres Altern, auch physiologisches Altern genannt, wird durch zelluläre Alternsprozesse hervorgerufen, die in Abwesenheit von Krankheiten ablaufen. Diese Form des Alterns definiert für einen Organismus seine maximal erreichbare Lebensspanne (auch ‚maximal erreichbares Alter‘ genannt, engl.: maximum attainable age). Beim Menschen liegt dieser Wert bei ungefähr 120 Jahren (siehe auch: Ältester Mensch) und wird mit dem griechischen Buchstaben ω (Omega, Symbol für das Ende) versehen. Andere Autoren setzen ω auf den Wert 122,45 Jahre. Dies ist das Alter, das Jeanne Calment zum Zeitpunkt ihres Todes erreichte, und das bisher höchste verifizierte Alter eines Menschen. Bisher sind keine evidenzbasierten Mittel (beispielsweise Arzneistoffe) und sonstige Behandlungsmethoden bekannt, durch die das primäre Altern beim Menschen verzögert oder gar verhindert werden kann. In verschiedenen Tiermodellen konnte das primäre Altern durch bestimmte Maßnahmen, wie beispielsweise Kalorienrestriktion oder die Gabe von Rapamycin, verzögert werden.
- Als sekundäres Altern bezeichnet man dagegen die Folgen äußerer Einwirkungen, die die maximal erreichbare Lebensspanne verkürzen. Dies können beispielsweise Krankheiten, Bewegungsmangel, Fehlernährung oder Suchtmittelkonsum sein. Das sekundäre Altern kann somit durch den Lebensstil beeinflusst werden.
Der Gegenstand dieses Artikels ist im Wesentlichen das primäre Altern. Die beiden Formen des Alterns lassen sich in der Praxis nicht immer eindeutig unterscheiden. Die Gerontologie ist die Alters- und Alternswissenschaft und behandelt entsprechend alle Aspekte des Alterns. Die Biogerontologie setzt sich mit den biologischen Ursachen des Alterns auseinander. Die Geriatrie ist dagegen die Lehre von den Krankheiten alter Menschen.
Seneszenz

Seneszenz (lat. senescere ‚alt werden‘, ‚altern‘) ist kein Synonym für Altern. Seneszenz kann als altersbedingte Zunahme der Mortalität (Sterberate) und/oder Abnahme der Fertilität (Fruchtbarkeit) definiert werden. Altern kann zur Seneszenz führen: Die Seneszenz ist der degenerative Abschnitt des Alterns. Nur wenn die schädlichen Effekte graduell und langsam akkumulieren, sollte man von Seneszenz sprechen. Häufig lässt sich dennoch nicht sauber zwischen Altern und Seneszenz unterscheiden. Der Anfang der Seneszenz wird meist auf einen Zeitpunkt nach dem Ende der Reproduktionsphase gelegt. Dies ist eine willkürliche Festlegung, die den Vorgängen bei verschiedenen Spezies nicht gerecht wird. So zeigen Wirbeltiere Phänomene der Seneszenz wie beispielsweise die Anreicherung des Alterspigmentes Lipofuszin noch während ihrer fruchtbaren Phase und Wasserflöhe legen trotz Seneszenz bis zu ihrem Tod fertile Eier. Ein typisches Kennzeichen der Seneszenz ist der Anstieg der Mortalitätsrate über die Zeit.
Viele altersbedingte Veränderungen in adulten Organismen haben keinen oder kaum einen Einfluss auf die Vitalität oder Lebensdauer. Dazu gehört beispielsweise das Ergrauen der Haare durch eine verminderte Expression der Katalase CAT und der beiden Methioninsulfoxidreduktasen MSRA und MSRB.
Die Alterung der Zellen (Zellalterung) wird als Zellseneszenz bezeichnet.
Lebenserwartung und Lebenspotenzial
Sowohl die durchschnittliche Lebenserwartung als auch die maximal erreichbare Lebensspanne ω sind von Organismus zu Organismus sehr unterschiedlich. Eintagsfliegen und Galápagos-Riesenschildkröten sind dabei Extrembeispiele. Die statistisch ermittelte Lebenserwartung eines Individuums ist bei jedem Organismus erheblich geringer als die maximale Lebensdauer. Der Katastrophentod durch Krankheiten, Unfälle oder Prädatoren (Fressfeinde) führt dazu, dass die meisten Organismen in freier Wildbahn nicht in den Bereich ihres Wertes für ω kommen. Lediglich ein kleiner Teil der Todesfälle ist alternsbedingt. Beim Menschen kann über seine Entwicklungsgeschichte, insbesondere der letzten 100 Jahre, eine zunehmende Annäherung der mittleren Lebenserwartung der Bevölkerung an die maximale Lebensdauer beobachtet werden.
Nicht-biologische Formen des Alterns
Neben dem biologischen Altern gibt es beim Menschen noch andere Formen des Alterns. Dazu zählt das psychologische Altern. Darunter versteht man die Veränderungen kognitiver Funktionen, Erfahrungen des Wissens und der subjektiv erlebten Anforderungen, Aufgaben und Möglichkeiten des Lebens. Dabei können sich durch das Altern auch Stärken, wie beispielsweise bereichsspezifische Erfahrungen, Handlungsstrategien und Wissenssysteme, bilden.
Mit sozialem Altern sind die Veränderungen in der sozialen Position, die durch das Erreichen eines bestimmten Lebensalters oder einer bestimmten Statuspassage eintreten, definiert. Das Ausscheiden aus dem Berufsleben und der Eintritt in das Rentenalter ist in der Industriegesellschaft die Statuspassage, mit der das soziale Altern beginnt. Mit den Aspekten des sozialen Alterns befassen sich unter anderem die Disengagementtheorie (der selbstbestimmte Rückzug aus sozialen Kontakten), die Aktivitätstheorie und die Kontinuitätstheorie des Alterns. Die Weltgesundheitsorganisation (WHO) fördert seit den 1990er Jahren durch das Konzept des Aktiven Alterns den Versuch, bei alternden und alten Menschen Kompetenzen zu erhalten und in Form von Teilhabe wirksam werden zu lassen.
Vom Altern nicht betroffene Organismen



Altern ist ein Vorgang, der viele höhere Organismen ihr ganzes Leben begleitet und in letzter Konsequenz zu ihrem Tod führen kann. Viele Organismen mit differenzierten somatischen Zellen („normale“ diploide Körperzellen) und Gameten (Keimzellen, das heißt haploide Zellen) mit Keimbahn altern und sind sterblich.
Mehrjährige Pflanzen bilden hier eine wichtige Ausnahme, da sie durch vegetative Vermehrung potenziell unsterblich sind. Im Pflanzenreich findet sich eine Vielzahl von Arten, die – nach gegenwärtigem Kenntnisstand – nicht altern. Beispielsweise produziert eine über tausend Jahre alte Stieleiche jedes Jahr Blätter und Eicheln von immer derselben Qualität. Wenn der Baum stirbt, dann durch äußere Einflüsse, wie beispielsweise Brände oder Pilzbefall.
Viele niedere Organismen, die keine Keimbahn aufweisen, altern nicht und sind potenziell unsterblich. Man spricht dabei auch von einer somatischen Unsterblichkeit. Zu diesen potenziell unsterblichen Organismen gehören die Prokaryoten, viele Protozoen (beispielsweise Amöben und Algen) und Arten mit ungeschlechtlicher Teilung (beispielsweise auch Mehrzeller wie Süßwasserpolypen (Hydra)). Faktisch haben diese Organismen allerdings sehr wohl eine begrenzte Lebensdauer. Äußere Faktoren, wie beispielsweise ökologische Veränderungen oder Fressfeinde (Prädatoren), limitieren die Lebenserwartung erheblich und führen zum sogenannten Katastrophentod.
Von besonderem wissenschaftlichen Interesse sind höhere Organismen, die, nachdem sie adult wurden, offensichtlich nicht weiter altern und keine Anzeichen von Seneszenz zeigen. Man spricht dabei von „vernachlässigbarer Seneszenz“ (englisch negligible senescence). Kennzeichen solcher Organismen sind eine über das Alter konstante Reproduktions- und Sterberate; im Gegensatz zu alternden Organismen bleibt ihre spezifische Mortalität also mit zunehmendem Lebensalter konstant. Für einige Spezies werden diese Eigenschaften vermutet. Dazu gehört beispielsweise der Felsenbarsch Sebastes aleutianus (englisch Rougheye rockfish), von dem ein 205 Jahre altes Exemplar nachgewiesen wurde, und die Amerikanische Sumpfschildkröte (Emydoidea blandingii). Einige Autoren sehen auch beim Nacktmull – als bisher einzigem Säugetier – eine vernachlässigbare Seneszenz. Generell gestaltet sich die Beweisführung, dass überhaupt eine höhere Art eine vernachlässigbare Seneszenz aufweist, als sehr schwierig. Extrem alte Exemplare sind sehr selten, da keine Art gegen einen Katastrophentod gefeit ist. Daten von Tieren in Gefangenschaft liegen bisher für keinen ausreichend langen Zeitraum vor. Das Postulat der vernachlässigbaren Seneszenz wurde erst 1990 aufgestellt.
Die Qualle Turritopsos Nutricula soll ihre Zellen erneuern können, wenn die Lebensfunktionen nachlassen. Laut des Forschers Ferdinando Boero sei dieser Zustand erreicht, lasse sie sich auf den Meeresboden hinabsinken und regeneriere dort ihr Zellvolumen. Sie lebt ohne Begrenzung, sofern sie nicht beispielsweise von anderen Tieren getötet wird.
Bei nichtalternden Organismen ist die Wahrscheinlichkeit des Todes unabhängig von Alter und Zeitpunkt. Die altersspezifische Mortalitätsrate, das ist die Anzahl der Todesfälle in einer bestimmten Altersklasse, ist deshalb konstant. Die Überlebenskurve nichtalternder Organismen ist in halblogarithmischer Darstellung eine Gerade.
Bei den „unsterblichen“ Bakterien oder sich spaltenden Hefen sind die Tochterzellen weitgehend identische Kopien der Ausgangszellen. Es wird diskutiert, ob in solchen Fällen wirklich von einer Unsterblichkeit gesprochen werden kann, schließlich entstehen zwei neue Individuen. Unabhängig von dieser philosophischen Frage dürfen solche Zellen keine Alterserscheinungen zeigen: Diese würden auf die Tochterzellen übertragen, von Generation zu Generation sich anhäufen (akkumulieren) und letztlich die gesamte Spezies auslöschen (eliminieren). In Vielzellern (Metazoa) und knospender Hefe kann dagegen das Altern in den somatischen Zellen, beziehungsweise Mutterzellen, stattfinden. Die für die Erhaltung der Art wichtigen Keimzellen – im Fall der Hefe Tochterzellen – müssen dagegen intakt bleiben.
Modellorganismen der Alternsforschung

Für die Grundlagenforschung über die Vorgänge und Ursachen zum Altern werden im Wesentlichen kurzlebige Spezies wie Taufliegen, Fadenwürmer und Farbmäuse verwendet. Dabei werden beispielsweise die Auswirkungen von potenziellen Wirkstoffen, der Ernährung und anderer äußerer Lebensbedingungen sowie von Manipulationen des Genoms untersucht. Als man in den 1980er-Jahren damit begann, mit sehr einfachen Organismen biogerontologische Versuche durchzuführen, war es noch nicht absehbar, dass dies – aus genetischer Sicht betrachtet – ein Glücksgriff war. Erst zu Beginn des 21. Jahrhunderts wurde mit der Entschlüsselung des Genoms verschiedener Modellorganismen und des Menschen festgestellt, dass eine sehr hohe Anzahl von Genen bei diesen Spezies übereinstimmen. Gerade die Gene, die einen erheblichen Einfluss auf das Altern haben, sind teilweise hochkonserviert und ermöglichen eine Übertragung der Forschungsergebnisse auf andere Spezies. Menschliche Alternsprozesse, die über viele Jahrzehnte ablaufen, lassen sich allerdings nur unzureichend abbilden. Taufliegen haben beispielsweise andere altersassoziierte Erkrankungen als Menschen.
Einige Forschungsgruppen gehen einen anderen Weg. Sie untersuchen das Genom und die Lebensbedingungen von Spezies, die vergleichsweise alt werden. Dazu gehören insbesondere der Nacktmull (Heterocephalus glaber) und die Little Brown Bat (Myotis lucifugus), eine nordamerikanische Fledermausart aus der Gattung der Mausohren. Die mausgroßen Nacktmulle übertreffen gleich große Nagetiere bei der maximalen Lebensspanne um den Faktor neun. Sie haben keine altersbedingte Zunahme der Mortalität, wie sie sonst bei jedem anderen Säugetier vorhanden ist. Darüber hinaus zeigen Nacktmulle über ihre gesamte Lebensspanne nur geringe altersbedingte Veränderungen. Die fortpflanzungsfähigen Weibchen haben bis in die dritte Lebensdekade eine gleichbleibende Fruchtbarkeit. Bisher wurden auch noch bei keinem Nacktmull spontane Tumoren beobachtet. Die maximal 14 g schweren Fledermäuse werden in der Wildnis bis zu 34 Jahre alt. Auch das Genom des Grönlandwals, der über 200 Jahre alt werden kann, ist von wissenschaftlichem Interesse.
In der Biogerontologie haben sich einige Tiermodelle zur Erforschung des Alterns etabliert. Dazu gehören neben den nachfolgend beschriebenen Fadenwürmern und Fruchtfliegen vor allem die Backhefe (Saccharomyces cerevisiae) und die Farbmaus.
Caenorhabditis elegans
Der adulte Fadenwurm Caenorhabditis elegans besteht aus lediglich 959 somatischen Zellen, die alle post-mitotisch, das heißt nicht mehr teilungsfähig, sind. 2002 waren schon über 50 verschiedene Mutanten bekannt, die gegenüber dem Wildtyp ein verlangsamtes primäres Altern aufweisen und so eine höhere Lebensspanne erreichen. Ein Teil der dabei identifizierten Gene beeinflusst die Stressresistenz der Versuchstiere positiv; andere wirken unmittelbar auf die Stoffwechselrate und senken diese. Der Einfluss auf die Stoffwechselrate passt unmittelbar zu den Vorhersagen der Disposable-Soma-Theorie (siehe unten). Eine Mutation im clk-1-Gen (ein Clock-Gen in der mitochondrialen DNA) von C. elegans kann seine mittlere Lebensdauer um 50 % erhöhen. Außer durch Mutationen in der mitochondrialen DNA kann das Altern von C. elegans auch durch niedrige Temperaturen – die unmittelbar die Körpertemperatur herabsetzen –, Kalorienrestriktion und eine verminderte Expression von Insulin bzw. insulinähnlichen Wachstumsfaktoren signifikant reduziert werden. Werden alle vier Maßnahmen gleichzeitig angewendet, so addieren sich die lebensverlängernden Effekte. Allerdings sind vom Wirkungsmechanismus her offensichtlich nur die Kalorienrestriktion und die Reduzierung der Temperatur voneinander unabhängige Parameter.
In neuen Studien konnte nachgewiesen werden, dass die durch Mitochondrien vermittelte Lebensverlängerung in C. elegans direkt mit dem Energiestoffwechsel zusammenhängt und von Gewebe zu Gewebe weitervermittelt werden kann, wobei der Stoffwechsel der Zelle (ohne Mitochondrium) unberührt bleibt.
Drosophila melanogaster
Die Taufliege Drosophila melanogaster ist für die Erforschung der Prozesse des Alterns ein häufig verwendeter Modellorganismus. Das auf nur vier Chromosomen befindliche Genom wurde bereits im Jahr 2000 vollständig sequenziert und der zeitliche Abstand einer Generationsfolge ist mit neun bis 14 Tagen sehr kurz.
Durch eine Mutation im mth-Gen (englisch methuselah, dt. Methusalem) erhöht sich die Lebenserwartung dieser Spezies um 35 %. Die mutierten Tiere sind gegenüber verschiedenen Formen von Stress deutlich beständiger. Auch eine teilweise Deaktivierung von Genen, die unmittelbar in die Elektronentransportkette in den Mitochondrien eingreifen (ETC-Gene, engl. electron transport chain), erhöht die Lebenserwartung von D. melanogaster.
Biomarker für das Altern

Altern ist ein dynamischer Prozess, der nicht nur von der Spezies, dem Geno- und Phänotyp, sondern auch von äußeren Einflüssen (sekundäres Altern) abhängig ist. Für Populationen lassen sich durch die Überlebens- beziehungsweise Mortalitätsraten Aussagen über das Altern treffen. Dabei dient als sehr einfacher „Biomarker“ der Tod der Individuen. Der kann wiederum individuell sehr verschiedene, auch nicht altersbedingte, Ursachen haben, weswegen der Tod eine individuelle Aussage über das momentane biologische Alter, gewissermaßen als aktuellen Status, nicht liefert. Auch das chronologische Alter eines Organismus kann nur begrenzt Informationen liefern.
Biomarker des Alterns sind Merkmale, die eine bessere Vorhersage der tatsächlichen Funktionsfähigkeit des Organismus in einem höheren Alter erlauben und dabei zuverlässiger als das chronologische Alter sind. Anders ausgedrückt, zeigen die Biomarker des Alterns das wahre „biologische Alter“ in einer Weise auf, wie es das chronologische Alter nicht vermag. Validierte Biomarker des Alterns ermöglichen eine Prüfung, ob bestimmte Eingriffe der Verlängerung der Lebensdauer dienlich sind, indem Veränderungen in den Biomarkern beobachtet werden, die auf ein niedriges biologisches Alter hinweisen. Im Idealfall sollten die Biomarker des Alterns nur den biologischen Prozess des Älterwerdens prüfen, jedoch nicht die Prädisposition für eine bestimmte Krankheit. Die Messung der Biomarker sollte den Organismus dabei möglichst wenig negativ beeinflussen, reproduzierbar sein und die Ergebnisse für eine kurze Zeitspanne müssen direkt im Verhältnis zur gesamten Lebenszeit des Organismus stehen. Eine internationale Forschergruppe hat erstmals eine molekulare Signatur entdeckt, welche das biologische Alter bestimmt und durch einen Bluttest ermittelt werden kann.
Die Fragestellung ist, wie kann das biologische Alter gemessen, beziehungsweise das Fortschreiten (Progression) des Alterns, eines Individuums bestimmt werden? Die Schwierigkeit dabei ist, dass Altern ein komplexer mehrdimensionaler Vorgang ist. In den einzelnen Dimensionen kann das Altern sehr unterschiedlich ablaufen. So kann beim Altern des Menschen beispielsweise einerseits die Gedächtnisleistung ab-, das Erfahrungswissen aber zeitgleich zunehmen. Körperliche Beeinträchtigungen können durch psychische Anpassungen so kompensiert werden, dass das Wohlbefinden subjektiv stabil bleibt. Das Altern kann auch beim Menschen sehr individuell verlaufen.
Äußere, kaum quantifizierbare, Zeichen des Alterns sind beim Menschen beispielsweise die Haltung, der Gang, die Elastizität der Haut (Falten) sowie die Haut- und Haarfarbe. Eine der Bestrebungen der Gerontologie ist es, die altersbedingten Funktionsverluste standardisiert messen zu können. Dies kann beispielsweise über Biomarker oder den sogenannten frailty index („Gebrechlichkeitsindex“) geschehen. Andere Tests erfassen eine Vielzahl von unterschiedlichen Messdaten wie beispielsweise Blutdruck, Vitalkapazität, Pulsfrequenz vor und nach einer körperlichen Belastung, Sauerstoffgehalt im Blut, Handkraft, Gelenkbeweglichkeit, Hör- und Sehvermögen, Reaktionszeiten, Konzentrations- und Koordinierungsfähigkeit sowie Gedächtnisleistungen. Ein häufig verwendeter Biomarker ist die Lungenfunktion. Mit zunehmendem Alter nimmt die Atemkapazität und die Ausblasgeschwindigkeit ab. Das Ziel dieser Tests zur Ermittlung des biologischen Alters ist es, Risikofaktoren frühzeitig zu erkennen und mögliche Präventivmaßnahmen einzuleiten. Ein Beispiel für ein solches standardisiertes Verfahren ist der Age Scan.
Der Nutzen dieser Verfahren, und allgemein der Biomarker für das Altern, ist umstritten. Einige Autoren bezweifeln den Sinn, da die Natur des Alterns noch weitgehend unklar ist. Zudem laufen viele Vorgänge des Alterns in einem Individuum unabhängig voneinander ab. Beispielsweise gibt es keinen Bezug zwischen dem Ergrauen der Haare und einer altersassoziierten Schwerhörigkeit. Die Alternsrate ist von Mensch zu Mensch unterschiedlich. Einige der Biomarker sind rein krankheitsassoziiert und eine Korrelation zum Altern selbst ist fragwürdig. So ist beispielsweise bei einer diagnostizierten Beeinträchtigung der Lungenfunktion die Mortalitätsrate in den nächsten 4 bis 20 Jahren höher als bei einer Normalfunktion. Die Haupttodesursachen sind allerdings kardiovaskulärer und maligner und nicht pulmonaler Natur, sodass die Kritiker die Frage stellen, ob die Lungenfunktionsmessung nicht eher ein Prädiktor für die beiden Krankheitsgruppen Herz-Kreislauf und Krebs als für das Altern ist. Darüber hinaus ist die Vorhersagekraft der gemessenen Lungenfunktion bezüglich der Mortalität nicht besser als das chronologische Alter des Betroffenen. Eine vorzeitige Mortalität durch bestimmte Krankheiten lässt sich zwar prognostizieren, Langlebigkeit jedoch nicht.
Biologische Uhren, zum Beispiel die epigenetische Uhr, sind vielversprechende Biomarker des Alterns. Steve Horvath entwickelte einen Marker, der über den Methylierungszustand der DNA Aufschluss über das Alter verschiedener Gewebe und Zelltypen gibt.
Bei im Labor gehaltenen Modellorganismen fehlt bisher ein zuverlässiger Biomarker, mit dem die individuelle Lebenserwartung vorhergesagt werden kann. Es wurde allerdings zum Beispiel gezeigt, dass die Anzahl der CD4- und CD8-T-Gedächtniszellen (auch CD4-Zellen mit P-Glykoprotein) und der naiven T-Zellen eine gute Vorhersage der erwarteten Lebensdauer von genetisch heterogenen Mäusen mittleren Alters ergeben.
Pathologie des Alterns
Altern ist ein physiologischer Vorgang und keine Krankheit. Das British Medical Journal veröffentlichte 2002 eine ‚Liste der Nicht-Krankheiten‘. Die Leser wählten dabei ‚Altern‘ (ageing) an die erste Stelle der Nicht-Krankheiten. Aus dem Bereich der Anti-Aging-Bewegung vertreten einige Protagonisten, wie beispielsweise Aubrey de Grey und David A. Sinclair, die Meinung, dass Altern sehr wohl eine Krankheit ist, die zu bekämpfen sei. Die US-amerikanische Food and Drug Administration (FDA) sieht im Altern keine Indikation gegeben. Das heißt, Altern ist nach Maßgabe der FDA kein Krankheitsbild, für das der Einsatz einer bestimmten medizinischen Maßnahme angebracht ist.
Altern ist nicht zwangsläufig mit Krankheiten verbunden. Das Alter ist aber ein bedeutsamer Risikofaktor für die Gesundheit. Die mit dem Altern einhergehende verringerte Anpassungs- und Widerstandsfähigkeit des Organismus führt zu einer erhöhten Störungsanfälligkeit. Chronische Erkrankungen nehmen zu, treten häufig gemeinsam auf (Multimorbidität) und erhöhen die Sterblichkeit. Die Sterblichkeitsrate steigt mit der Zunahme von körperlichen Defiziten exponentiell an. Typischerweise beschleunigt sich das Ansammeln dieser Defizite bei älteren Menschen vor ihrem Tod.
Altern ist derzeit zumeist keine primäre Todesursache: Durch das Altern bedingte zelluläre und daraus folgende organische Veränderungen erhöhen die Wahrscheinlichkeit, an einer Alterskrankheit oder an einer in jungen Jahren eher unkritischen Krankheit zu sterben. Typische Alterskrankheiten sind viele Herz-Kreislauf-Erkrankungen, Erkrankungen der Gehirngefäße, Bronchitis, Diabetes mellitus Typ II, Osteoporose, Arthrose und auch Krebs. Alterskrankheiten zählen zu den Hauptursachen, warum die maximale Lebensspanne nur äußerst selten erreicht werden kann.
Physiologisch betrachtet ist das Altern durch einen langsamen und progressiven Verlust verschiedener Körperfunktionen gekennzeichnet, von dem alle Organsysteme betroffen sind. Der Zeitpunkt des Nachlassens dieser Funktionen ist von Organ zu Organ sehr unterschiedlich. So nimmt beim Menschen beispielsweise die glomeruläre Filtrationsrate (GFR) der Nieren (die Nierenleistung) schon in der Kindheit ab, während die Nervenleitungsgeschwindigkeit erst ab 30 Jahren nachlässt. Aus dem Bereich der Inneren Medizin ist außer der GFR vor allem noch das Nachlassen der Vitalkapazität der Lungenfunktion, der maximalen Sauerstoffaufnahmekapazität, des Atemzugvolumens, des Blutflusses im Gehirn und in der Leber sowie des Herzschlagvolumens zu beobachten. Als wichtigste neurologische Veränderung ist eine nachlassende Gedächtnisfunktion feststellbar. Das Hormonsystem produziert weniger Hormone. Der Verdauungstrakt reduziert die Sekretion von Verdauungsenzymen und die Verwertung von Nährstoffen lässt – wie auch die Peristaltik des Darmes – nach. Zu diesen organspezifischen Veränderungen kommt noch ein systemischer Verlust von Strukturproteinen, der sich vor allem als Verlust von Muskelmasse, Bindegewebe und Unterhautfettgewebe äußert.
Die nachfolgende Tabelle gibt eine Übersicht über die wichtigsten altersbedingten Veränderungen.
| Organ/System | Altersbedingte Veränderungen | Mögliche Folgen |
|---|---|---|
| Sinnesorgane | Augen: Alterssichtigkeit (Presbyopie), Linsentrübung | verminderte Akkommodation, Abnahme des Sehvermögens |
| Ohren: Hochtonverluste (Presbyakusis) (umweltabhängig) | eingeschränkte Wortdiskrimination bei Hintergrundgeräuschen | |
| Hormonsystem | beeinträchtigte Glucosetoleranz | erhöhter Blutzuckerspiegel bei akuten Krankheiten |
| Abnahme der Vitamin-D-Absorption und -Aktivierung in der Haut | u. a. Osteopenie | |
| Abnahme der Thyroxinausscheidung und -produktion | verminderte Thyroxin-Dosis bei Hypothyreose notwendig | |
| Abnahme des Blutöstrogenspiegels bei der Frau | Wechseljahre, Menopause | |
| Abnahme des Testosteron-Estradiol-Quotienten beim Mann | ||
|
Herz-Kreislauf-System und Atemtrakt |
abnehmende Anpassung der Arterien, zunehmender systolischer und diastolischer Blutdruck (abhängig von Umwelt und Lebensweise) | orthostatische Probleme |
| verzögerte Blutdruckregulation | ||
| Einschränkung des Herzschlagvolumens | Belastungen können nur durch erhöhte Herzfrequenz kompensiert werden | |
| Abnahme der Lungenelastizität | abnehmender Sauerstoffpartialdruck | |
| Urogenitaltrakt | Perzeption von Durst nimmt ab, die Perzeption der Sättigung nimmt zu | erhöhte Gefahr der Exsikkose |
| Harnblase: Tonus nimmt zu, Kapazität nimmt ab | häufigeres Urinieren, meist mit verkürzter Drangzeit; erhöhter Wasserverlust | |
| Niere: glomeruläre Filtrationsrate nimmt ab | mangelnde Ausscheidung von Medikamenten und Drogen | |
| benigne Prostatahyperplasie (gutartige Vergrößerung der Prostata) | nächtliches Wasserlassen, Harnverhalt | |
| Blut- und Immunsystem |
Abnahme der Knochenmarkreserve (vermutet) | verminderte Immunantwort |
| abnehmende Funktion der T-Lymphozyten | ||
| Zunahme der Autoantikörper | ||
| Stütz- und Bewegungsapparat | Abnahme der Muskelmasse | reduzierte Beweglichkeit und Kraft |
| Skelettmuskulatur nimmt ab | ||
| Bänder, Sehnen und Muskeln sind weniger dehnbar | ||
| Abnahme des Mineralstoffgehaltes der Knochen | erhöhte Anfälligkeit für Knochenbrüche | |
| die Beweglichkeit der Gelenke nimmt ab | ||
| Nervensystem | Abnahme der Ganglienzellen und Neurotransmitter | Beeinträchtigte Stoffwechselvorgänge;
Verlangsamte Informationsverarbeitung |
| Reduzierung der Phospholipide in Zellmembranen | erhöhte Aufnahme schädlicher Substanzen | |
| Beeinträchtigung der Funktion der Rezeptoren | verminderte Aufnahme von Glucose | |
| Neuronenverlust im Hippocampus um bis zu 20–30 % bis zum 80. Lebensjahr | verminderte Gedächtnisleistung | |
| Verringerte elektrophysiologische Aktivität |
In Deutschland hat sich, wie in vielen anderen Industrienationen auch, die Lebenserwartung in den letzten 100 Jahren nahezu verdoppelt. Die Ursache hierfür sind im Wesentlichen verbesserte Hygienebedingungen, Reduzierung der Sterblichkeitsrate von Neugeborenen und effektivere Therapien und Prävention einer Vielzahl von akuten Krankheiten. In den Vereinigten Staaten waren im Jahr 1900, mit einem Anteil von 31 % bei allen Sterbefällen, die drei häufigsten Todesursachen Influenza/Lungenentzündung, Tuberkulose und Gastroenteritis/Durchfall. 2002 stellten im selben Land mit Herzkrankheiten, Krebs und Schlaganfall, drei eindeutig altersassoziierte Erkrankungen mit zusammen 61 % aller Sterbefälle die häufigsten Todesursachen. Die Folge dieser Entwicklung ist, dass immer mehr Menschen älter werden. Die maximale Lebensspanne von etwa 120 Jahren hat sich durch diese Maßnahmen jedoch nicht verändert. Der Gerontologe Leonard Hayflick geht davon aus, dass dieser Wert in den letzten 100.000 Jahren der Menschheitsgeschichte konstant geblieben ist.
Genetische Einflüsse

Die extremen Unterschiede für ω bei den einzelnen Spezies werden von den meisten Wissenschaftlern mit einer genetischen Bestimmung begründet, was allerdings umstritten ist. Als programmiertes Altern bezeichnet man die genetisch gesteuerte Biomorphose (auch Ontogenese) und Differenzierung. Für diese beiden Vorgänge ist die genetische Steuerung unstrittig. Sehr kontrovers ist dagegen die Diskussion, ob es eine programmierte Seneszenz gibt und diese die Ursache für die Unterschiede von ω zwischen einzelnen Spezies ist.
Weitgehender Konsens herrscht darüber, dass innerhalb einer Spezies das Altern und die Lebenserwartung von bestimmten Genen beeinflusst wird. So wird auch beim Menschen beides, außer von seinem Lebensstil und anderen äußeren Einflüssen, zu einem Teil von seiner Genetik bestimmt. Man schätzt den Anteil der genetischen Disposition an der Lebenserwartung auf 20 bis 30 %. Statistisch gesehen steigt beim Menschen bis ungefähr zum 92. Lebensjahr die Sterbewahrscheinlichkeit (Mortalitätsrate) exponentiell an. Für noch ältere Altersgruppen flacht sie wieder ab. Der Anstieg der Sterblichkeit verlangsamt sich (englisch late-life mortality deceleration), geht aber keinesfalls zurück. Dies bedeutet eine Abweichung von dem 1825 von Benjamin Gompertz formulierten „Gesetz der Mortalität“ (Gompertz-Makeham-Modell). Frauen und Männer oberhalb eines Alters von 92 Jahren bilden bezüglich der Mortalität eine eigene Gruppe. Für dieses Phänomen werden im Allgemeinen die Erbanlagen („Altersgene“) und das für das Erkennen und Vernichten von Krebszellen wichtige Immunsystem verantwortlich gemacht. Der Einfluss der Erbanlagen auf die Langlebigkeit ist beim Menschen und einer Vielzahl von Modellorganismen eindeutig belegt. Entsprechend erreichen Kinder mit hochbetagten Eltern durchschnittlich ein höheres Lebensalter als Menschen, deren Eltern früher gestorben sind. Aus der Zwillingsforschung weiß man, dass bei zweieiigen Zwillingen der mittlere Unterschied in der Lebensdauer doppelt so hoch wie bei den genetisch identischen eineiigen Zwillingen ist.
Umgekehrt kann aus der genetischen Disposition bezüglich des Alterns nicht auf ein genetisches Programm Altern oder ein spezifisches „Alternsgen“, das das Altern eines Organismus fördert, geschlossen werden. Ein solches nachteiliges Gen wäre nach einer Mutation, die es funktionslos machen würde, durch die Evolution längst ausselektiert worden – wenn es nicht für die gesamte Spezies einen Vorteil bietet. Es gibt zumindest beim Menschen keine Gene für das Altern. Die Genetik des Alterns ist hochkomplex. Das Altern wird durch ein kontinuierliches Ansammeln von somatischen Schäden hervorgerufen, die eine Folge einer begrenzten Investition des Körpers in seine Wartung und Reparatur sind. Reparaturmechanismen, wie beispielsweise DNA-Reparatur und die Bekämpfung von oxidativem Stress, werden von Genen kontrolliert, die dadurch Einfluss auf die Langlebigkeit und das Altern des Organismus haben. Es gibt möglicherweise auch Anpassungen an die Folgen des Alterns: in Ratten ist die Expression von Megalin in den Nieren im Alter erhöht, wahrscheinlich um die steigende Anzahl der Defekte an dem großen Protein auszugleichen.
In natürlichen Lebensräumen ist die Sterblichkeit von Organismen – mit Ausnahme des Menschen – vor allem auf externe Ursachen (Katastrophentod) zurückzuführen. Altern ist eine Begleiterscheinung, die in freier Wildbahn kaum auftritt, da die meisten Organismen schon vorher sterben. Aus diesem Sachverhalt heraus lässt sich ableiten, dass ein genetisches „Todesprogramm“ als Ergebnis einer evolutionären Selektion sehr unwahrscheinlich ist. Das Altern ist weniger auf deterministische (zukünftige Ereignisse sind durch Vorbedingungen festgelegt) als auf stochastische Prozesse (zeitlich geordnete, zufällige Vorgänge) zurückzuführen.
Bei einigen semelparen Organismen gibt es eine Form von programmiertem Tod (Fortpflanzungstod). Am bekanntesten ist dabei der Lebenszyklus der Pazifischen Lachse (Oncorhynchus), die während ihrer Laichwanderung kaum noch oder gar keine Nahrung aufnehmen. Der Körper unterliegt erheblichen hormonellen Veränderungen und die Tiere verenden kurz nach ihrer Fortpflanzung in den Laichgewässern. Ähnliche Verhaltensweisen sind von Kraken (Octopoda) bekannt. Die Männchen der australischen Breitfuß-Beutelmäuse (Antechinus) sterben nach der Paarung, letztlich hervorgerufen durch eine Überproduktion von Testosteron und Cortisol.
Wissenschaftler des Deutschen Krebsforschungszentrums (DKFZ) in Heidelberg haben 2018 erstmals ein Protein namens TXNIP (Thioredoxin-interacting protein) entdeckt, das eine zentrale Schaltstelle im Alterungsprozess darstellt. Es kontrolliert die Lebensspanne eines Individuums – von der Fliege bis hin zum Menschen.
Mutationen, die das Altern beeinflussen können
Das Phänomen Altern hat einen genetischen Hintergrund. Der Fadenwurm Caenorhabditis elegans hat eine maximale Lebensspanne (ω) von wenigen Wochen. Der Mensch erreicht für ω einen Wert von etwa 120 Jahren. Beide Arten haben in ihrer Stammesgeschichte einen gemeinsamen Vorfahren. Geht man davon aus, dass dieser Vorfahre für ω einen ähnlichen Wert wie C. elegans hatte, so bedeutet dies, dass im Laufe der Jahrmillionen die Evolution durch Mutation und Selektion den Wert um das über 2000-fache gesteigert hat. Eines der von der Biogerontologie untersuchten Probleme ist es, die dafür verantwortlichen Gene zu identifizieren. Im Labor lässt sich in Modellorganismen – wie beispielsweise C. elegans – durch das gezielte Zu- oder Abschalten (Gen-Knockin beziehungsweise Gen-Knockout) bestimmter Gene der Wert von ω verkürzen oder verlängern. In der freien Natur können spontane Mutationen Gene betreffen, die einen unmittelbaren Einfluss auf das Altern haben. Dies kann sowohl beim Menschen als auch bei anderen Organismen beobachtet werden.
Progerie

Unter der Bezeichnung Progerie werden einige äußerst seltene Erbkrankheiten zusammengefasst, die durch ein um den Faktor fünf bis zehn beschleunigtes Altern der betroffenen Patienten gekennzeichnet sind. Ursache dieser Erkrankungen sind spontane Punktmutationen. Vom sogenannten Hutchinson-Gilford-Syndrom sind weltweit etwa 40 Kinder betroffen, die eine mittlere Lebenserwartung von ungefähr 14 Jahren haben. Einige der typischen alterassoziierten Erbkrankheiten wie Herzinfarkt oder Schlaganfall sind bei Kindern mit Progerie besonders häufig und die Haupttodesursache. Dagegen ist das Risiko, an Krebs oder Morbus Alzheimer zu erkranken, nicht erhöht. Progerie ist deshalb keine Erkrankung, die einem beschleunigten Altern unmittelbar entspricht. Aufgrund dieser Unterschiede zwischen Progerie und normalem Altern gibt es eine kontroverse Diskussion, ob Progerie wirklich eine Form des beschleunigten Alterns ist. Auf molekularbiologischer Ebene wurden inzwischen genügend Daten erhalten, die die Hypothese des beschleunigten Alterns zumindest für das Hutchinson-Gilford-Syndrom bestätigen. So wurden beispielsweise Parallelen bei der Instabilität des Genoms und des Telomer-Abbaus gefunden.
Eine besondere Form der Progerie stellt die Dyskeratosis congenita dar. Bei dieser sehr seltenen Erbkrankheit ist das Enzym Telomerase infolge einer Mutation direkt oder indirekt in seiner Funktion betroffen. Durch die eingeschränkte Aktivität der Telomerase werden die Telomere an den Enden der Chromosomen der betroffenen Patienten schneller abgebaut. Die Patienten altern unter anderem schneller als normal, haben fragile Knochen, unterentwickelte Hoden und zeigen eine Prädisposition für Krebserkrankungen.
Dwarf-Mäuse
Dwarf-Mäuse sind Mutanten der Art Mus musculus (Hausmaus, beziehungsweise deren Zuchtform Farbmaus, Gattung: Mäuse) und nicht mit der Art Zwergmäuse (Micromys minutus) aus der Gattung Micromys zu verwechseln. Diese Tiere weisen bedingt durch eine spontane Genmutation ein Defizit an Wachstumshormonen auf. So kann beispielsweise die Produktion von insulinähnlichen Wachstumsfaktoren (IGF-1), Thyreotropin (TSHB) und Prolactin (PRL) um über 99 % reduziert sein. Diese Mutation hat für die Dwarf-Mäuse zur Folge, dass sie deutlich langsamer altern und ihre Lebensspanne um 68 % (Weibchen) beziehungsweise 49 % (Männchen) höher als bei Tieren der gleichen Art ohne Mutation ist. Als Trade-off (Ausgleich) ist bei diesen Tieren – entsprechend der Life-history-Theorie – ein reduziertes Wachstum und eine geringere Fruchtbarkeit zu beobachten. So sind die Weibchen der Ames- und Snell-Dwarf-Mäuse unfruchtbar und die Männchen haben eine geringe Fertilität. Das Körpergewicht ist um 67 % geringer als beim Wildtyp.
Per Gen-Knockout lassen sich solche Mäuse seit Ende der 1980er Jahre gezielt im Labor produzieren. Daneben wurde eine Vielzahl von gentechnischen Veränderungen an Mäusen und anderen Organismen vorgenommen, bei denen die Werte von ω erhöht oder erniedrigt werden konnten.
Beispielsweise haben Mäuse, bei denen der Apoptoseinduktor p66Shc abgeschaltet wurde, eine um 30 % gesteigerte Lebenserwartung, die durch eine höhere Resistenz gegenüber oxidativem Stress hervorgerufen wird.
FOXO3
Eine Arbeitsgruppe um die Kieler Wissenschaftlerin Almut Nebel analysierte das Genom von 388 hundertjährigen Deutschen im Vergleich mit 731 jüngeren Personen. Dabei stellten sie fest, dass ein bestimmter Genotyp des FOXO3-Gens bei den Hundertjährigen besonders häufig anzutreffen ist. In der Presse wurden danach Begriffe wie Langlebigkeits-Gen, Alters-Gen, Greisen-Gen oder Methusalem-Gen verwendet. Schon ein Jahr zuvor hatte eine andere Arbeitsgruppe festgestellt, dass der FOXO3-Genotyp einen erheblichen Einfluss auf die Lebenserwartung eines Menschen hat. Studien in anderen Ländern kommen zu dem gleichen Ergebnis.
Das Genprodukt von FOXO3 wirkt als Transkriptionsfaktor unmittelbar auf die Genexpression von Sirtuin-1. Sirtuin-1 wird bei der Kalorienrestriktion vermehrt ausgeschüttet, die bei einer Vielzahl von Modellorganismen ein verzögertes Altern und eine höhere Lebenserwartung bewirkt. Sirtuin-1 wiederum hemmt mTOR (mammalian Target of Rapamycin) und kann durch bestimmte Substanzen, wie beispielsweise Resveratrol, aktiviert werden.
Gerontogene
In den beiden für die Biogerontologie wichtigen Modellorganismen Caenorhabditis elegans (Fadenwurm) und Drosophila melanogaster (Taufliege) konnten mehrere Gene identifiziert werden, die – wenn sie deaktiviert sind – die maximale Lebenserwartung dieser Tiere deutlich erhöhen können. Solche Gene werden als Gerontogene bezeichnet. Sie gelten als Beweis dafür, dass das Altern durch spezifische Gene reguliert wird.
Alternstheorien

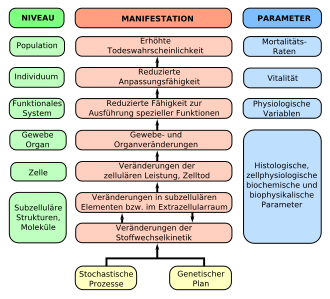
Das Altern ist das Ergebnis stochastischer Prozesse und eines genetischen Programms. Es beginnt auf der molekularen Ebene und setzt sich auf allen übergeordneten Ebenen (Niveaus, in Grün) bis zum Tod fort. In der Mitte (in Rot) sind die Ergebnisse der Alternsprozesse dargestellt. Die rechte Spalte führt die messbaren Kenngrößen dazu auf.
Zur Klärung der Frage, warum alle höheren Organismen altern, gibt es bis zum heutigen Tag keine allgemein wissenschaftlich akzeptierte Antwort. Für das Altern und den dadurch bedingten Tod gibt es auch für höhere Organismen – einschließlich des Menschen – kein Naturgesetz, das diesen Prozess zwangsläufig „vorschreibt“.
Der US-amerikanische Evolutionsbiologe George C. Williams formulierte dies 1957 mit den Worten:
„Es ist wirklich verwunderlich, dass – nachdem das Wunderwerk der Embryogenese vollbracht ist – ein komplexes Metazoon an der viel simpler erscheinenden Aufgabe scheitert, einfach das zu erhalten, was schon geschaffen ist.“
Die Ursachen des primären Alterns sind sehr vielschichtig und äußerst komplex. Als Folge davon gab es 1990 bereits etwa 300 verschiedene Theorien zum Altern, aber keine davon ist in der Lage, das Altern alleine zu erklären. Die Alternstheorien lassen sich in zwei Hauptgruppen einteilen: Evolutions- und Schadenstheorien. Gegenwärtig sehen die meisten Forscher in den Evolutionstheorien das beste Erklärungsmodell dafür, warum der Mensch und andere Organismen altern, auch wenn diese Theorien noch einige Schwächen aufweisen.
Die Geschwindigkeit des Alterns bestimmt die maximale Lebenserwartung eines Individuums. Dabei gibt es innerhalb einer Spezies leichte und zwischen einzelnen Spezies erhebliche Unterschiede. Zwischen den beiden Säugetieren Hausmaus und Grönlandwal besteht beispielsweise ein Unterschied von nahezu zwei Größenordnungen. Der Aufbau der Körperzellen, den elementaren Bausteinen beider Spezies, ist weitgehend gleich. Auch bei den aus den Zellen aufgebauten Organen und Geweben bestehen funktionell gesehen kaum Unterschiede. Die entscheidenden Unterschiede liegen im Genom, auch wenn dies in seiner Gesamtheit eine sehr hohe Ähnlichkeit aufweist.
Die maximale Lebensspanne wird durch eine Vielzahl sehr unterschiedlicher Gene bestimmt. Diese Gene werden offensichtlich nicht selektiert und sie beeinflussen den Prozess des Alterns nicht unmittelbar. Das Altern selbst ist im Wesentlichen die Folge der Akkumulation von somatischen Schäden, da zur Erhaltung des Somas nur begrenzt Ressourcen (Energie) eingesetzt werden. Diese Ressourcen sind limitiert und müssen zwischen Selbsterhaltung, Wachstum und Reproduktion aufgeteilt werden. Zudem gibt es noch pleiotrope Gene, die in jungen Jahren vorteilhaft für den Organismus sind, sich aber mit zunehmendem Alter nachteilig auswirken.
Die naturwissenschaftlich fundierten Alternstheorien werden in der Wissenschaftsgemeinde sehr kontrovers diskutiert. Einen allgemeinen Konsens gibt es bisher nicht. Die Meinungen der verschiedenen Lager gehen zum Teil sehr weit auseinander. So kommen beispielsweise die beiden renommierten britischen Forscher Sir Richard Peto und Sir Richard Doll bezüglich des Alterns sogar zu der extremen Aussage:
„Es gibt kein Altern – hohes Alter ist mit Krankheit verbunden, aber verursacht sie nicht.“
Diese Meinung wird von der Mehrzahl der Gerontologen nicht geteilt. Auf der anderen Seite der Extreme finden sich Gerontologen, die das Altern auf einfache Schadenstheorien, wie Telomerabbau, oxidative Schäden durch freie Radikale oder mitochondriales Altern, reduzieren.
Nachfolgend sind die wichtigsten Kategorien von Alternstheorien aufgeführt.
Schadenstheorien
Zu den populärsten und in der Bevölkerung am weitesten verbreiteten Theorien des Alterns gehören die Schadenstheorien. Nach ihnen ist das Altern ein Vorgang, der durch die Summe von Schäden, die durch zerstörerische Prozesse, wie Oxidation, Abnutzung oder die Akkumulation von schädlichen Nebenprodukten des Stoffwechsels, hervorgerufen wird. Organismen altern danach – stark vereinfacht ausgedrückt – ähnlich einem Auto oder einer Außenfarbe. Die bekannteste Theorie dazu ist die auf der Rate-of-Living-Theorie aufbauende Theorie der freien Radikale von Denham Harman. Sie dient auch als Erklärungsmodell für die Entstehung von Krankheiten wie beispielsweise Krebs, Arteriosklerose, Diabetes mellitus und Alzheimer. Nach der anfänglichen Ablehnung wurde die Theorie in den 1990er Jahren außerordentlich populär. Antioxidantien, die im Labor als Radikalfänger in der Lage sind, freie Radikale abzufangen, wurden als potenzielle Wirkstoffe gegen das Altern und altersbedingte Erkrankungen gesehen. Diese Euphorie hat sich inzwischen – zumindest in der Gerontologie – gelegt. Für die Theorie der freien Radikale gibt es eine Reihe von experimentellen Ergebnissen, die sie unterstützen. So wurde in vergleichenden Studien unterschiedlicher Spezies festgestellt, dass die Lebenserwartung sehr stark mit der Fähigkeit der Zellen oxidativen Stress zu überstehen korreliert. Andererseits sind einige grundlegende experimentelle Beobachtungen völlig konträr zu dieser Theorie. So wurden in den Zellen der vergleichsweise langlebigen Nacktmulle hohe Werte oxidativer Schäden festgestellt. Eine durch Gen-Knockout induzierte deutlich verminderte Expression von wesentlichen Elementen des Antioxidativen Systems, beispielsweise von Mangan-Superoxid-Dismutase (MnSOD), erhöht zwar die Inzidenz für Krebs, beschleunigt aber nicht das Altern der Versuchstiere. In einer Vielzahl von klinischen Studien konnten zudem keine positiven Effekte bei der Einnahme von Antioxidantien festgestellt werden. Anti-Aging-Produkte, die sich auf den antioxidativen Effekt berufen, haben beim Menschen vermutlich gar keine Wirkung. Noch einen Schritt weiter geht die Arbeitsgruppe um Michael Ristow, die zeigen konnte, dass freie Radikale notwendig sind, um die Mitohormesis in Gang zu setzen. Dadurch erreicht die Zelle in einer Art „Training“ eine erhöhte Abwehrkapazität gegen freie Radikale. Antioxidantien verhindern dagegen die Mitohormesis.
Nach der Fehler-Katastrophen-Theorie (AE: error catastrophe (of aging)), 1963 erstmals von Leslie Orgel aufgestellt, gibt es zwei Arten von Proteinen innerhalb einer Zelle: solche die Stoffwechselfunktionen ausüben und solche, die in Informationsprozesse involviert sind. Schäden in einem metabolischen Protein seien demnach für die Zelle nicht relevant, da es nur ein falsches Protein von vielen anderen (richtigen) ist. Fehler in den molekularen ‚Kopierprozessen‘ (Transkription und Translation) von Proteinen, die ihrerseits an der Proteinsynthese beteiligt sind, könnten aber eine ganze Fehlerkaskade in der Zelle auslösen. Die mit steigendem Alter zunehmende Anzahl von Fehlern in der Aminosäurensequenz der Proteine einer Zelle sei – so die Theorie – letztlich die Ursache für das Altern. Die Akkumulation der Fehler führt in letzter Konsequenz zum Zelltod. Für die Fehler-Katastrophen-Theorie gibt es bisher keine experimentellen Beweise; eine Reihe von Versuchsergebnissen spricht gegen die Theorie. Es war allerdings auch nicht Orgels Absicht mit seiner Theorie eine neue Alternstheorie aufzustellen.
Als beschreibende Theorien bieten die Schadenstheorien zwar einen Erklärungsansatz für die Prozesse beim Altern, aber keine Antwort darauf, warum Organismen altern. Zudem ist der Vergleich mit der Alterung eines toten Gegenstandes im Ansatz falsch: Organismen stellen dynamische Systeme mit einem ständigen Stoffaustausch dar; sie kämpfen während ihres gesamten Lebens gegen die Entropie (Henri Bergson).
In ungefähr sieben Jahren ersetzt der menschliche Körper 90 % der Bestandteile aus denen er aufgebaut ist. Körperzellen verfügen über eine Vielzahl von Reparaturmechanismen. Beispielsweise finden pro Tag im Genom jeder einzelnen menschlichen Körperzelle mehr als 55000 Einzelstrangbrüche, 12000 Basenverluste, 200 Desaminierungen und 10 Doppelstrangbrüche statt, die durch entsprechende Mechanismen weitgehend repariert werden. Tote Zellen in Organen können durch neu gebildete ersetzt werden und einige Spezies sind sogar in der Lage verlorene Körperteile wieder vollständig herzustellen. Eine Antwort auf die Frage, warum in vielen Organismen diese zweifelsfrei vorhandenen Reparaturprozesse nur unzureichend genutzt werden, liefern die Schadenstheorien nicht.
Telomer-Hypothese des Alterns

Die Telomer-Hypothese des Alterns baut auf der 1965 von Leonard Hayflick gefundenen Hayflick-Grenze auf. Die Hypothese wurde 1991 von Calvin Harley aufgestellt. Nach dieser Hypothese haben die Telomere für das Altern einer Zelle und dadurch für den Gesamtorganismus eine entscheidende Funktion. Vom Zeitpunkt der Geburt aus gerechnet verkürzen sich die Telomere an den Chromosomenenden etwa parallel zum Alter: Je mehr Zellteilungen eine Zelle durchlaufen hat, umso kürzer sind die Telomere. Elizabeth Blackburn hat entdeckt, dass durch die Telomerase ein Organismus die Telomere in beschränktem Maße wiederherstellen kann. Umwelteinflüsse können die Telomerlänge jedoch ebenfalls verkürzen. Zum Ende des Alterns hin verlangsamt sich die Zellteilungsrate und ab einer bestimmten Telomerlänge teilt sich die Zelle überhaupt nicht mehr. Sie wird seneszent. Der Zeitpunkt, zu dem eine Zelle dieses Stadium erreicht, ist zum einen vom Zelltyp und zum anderen von der Spezies abhängig.
Die Verkürzung der Telomere ist in einer Vielzahl von mitotisch aktiven Geweben zu beobachten. Dazu gehören vor allem die Hautfibroblasten, die peripheren Blutzellen, die Epithelien des Magen-Darm-Traktes Zellen der Nebenniere im Nierenkortex, der Leber und der Milz. In mitotisch inaktiven Organen, wie dem Gehirn und dem Herzmuskel, sind über den gesamten Zeitraum des Alterns die Telomerlängen weitgehend konstant. Für eine Reihe von chronischen Erkrankungen verschiedener Organe konnten erhöhte Telomerverkürzungen nachgewiesen werden. So beispielsweise im Endothel bei Atherosklerose und in den Hepatozyten bei chronischen Lebererkrankungen.
Zwischen der Anzahl der durch die Telomerlänge begrenzten Zellteilungen und der maximalen Lebensspanne ω eines Organismus besteht eine Korrelation. Das Proliferationspotenzial (Zellteilungsvermögen) ist bei langlebigen Organismen höher.
| Spezies | ω [a] |
Maximale Anzahl an Zellteilungen |
|---|---|---|
| Galápagos-Riesenschildkröte | 175 | 125 |
| Mensch | 110 | 60 |
| Hauspferd | 46 | 82 |
| Haushuhn | 30 | 35 |
| Hauskatze | 28 | 92 |
| Känguru | 16 | 46 |
| Amerikanischer Nerz | 10 | 34 |
| Hausmaus | 4 | 28 |
Als ein Beweis für die Telomer-Hypothese des Alterns wird das Schaf Dolly gesehen. Dolly wurde aus einer somatischen Zelle eines fünf Jahre alten Schafes geklont. Bei dem Spender-Schaf waren die Telomere in der entnommenen Zelle durch eine Vielzahl von Teilungen bereits erheblich verkürzt. Dolly verstarb deutlich vor dem Erreichen der mittleren Lebenserwartung eines Schafes und zeigte einen früh einsetzenden und schnellen Prozess des Alterns.
Bei Patienten, die am Werner-Syndrom, einer seltenen Erbkrankheit mit beschleunigtem Altern, erkrankt sind, können sich die Zellen im Durchschnitt nur etwa zwanzigmal teilen und werden danach seneszent.
Im Modellorganismus Caenorhabditis elegans hat die Telomerlänge dagegen keinen Einfluss auf das Altern. Die langlebigen daf-2- und die kurzlebigen daf-16-Mutanten können kurze oder lange Telomere haben, beides ändert die Lebensspanne der Tiere nicht.
Zellalterung, zelluläre Seneszenz – Krebs oder Altern

Bis in die 1950er Jahre wurde das Altern als langsame Abnutzung (Verschleiß) der Zellen, der daraus gebildeten Gewebe und Organe und des daraus aufgebauten Körpers verstanden. Die molekularen Ursachen des Alterns wurden nicht erkannt beziehungsweise verstanden. Nachdem es gelang, Säugetierzellen in vitro zu kultivieren, wurde es möglich, die molekularen Veränderungen zu analysieren und zu verstehen. Erst 1961 wurde durch die Versuche von Leonard Hayflick festgestellt, dass sich normale menschliche Zellen nicht beliebig oft teilen können und nicht unsterblich sind. Humane Fibroblasten aus Feten können sich in einer Zellkultur 60- bis 80-mal teilen; die gleichen Zellen aus einem älteren Erwachsenen dagegen nur noch 10- bis 20-mal. Diesen Vorgang der Zellalterung nennt man zelluläre oder replikative Seneszenz. Die Zellen verharren in der G1-Phase des Zellzyklus, die S-Phase wird nicht mehr erreicht. Die Zellen funktionieren normal weiter, replizieren sich aber nicht mehr. Viele dieser Zellen sind dann auch ausdifferenziert, das heißt, sie haben ihre spezielle endgültige physiologische Funktion übernommen. Die seneszenten Zellen sind dann auch gegen den programmierten Zelltod, die Apoptose, resistent. Die für eine Zelle zulässige Anzahl der Teilungen ist in der DNA über Telomere vorprogrammiert. Bei Tieren mit kurzer Lebensspanne können sich die Zellen weniger oft teilen als bei Tieren mit einer höheren Lebensspanne.
Nicht alle Zellen des Körpers werden seneszent. Wäre dies der Fall, so gäbe es beispielsweise keine Wundheilung. Ein Teil der Zellen wird deshalb nicht seneszent: die Stammzellen. Aus diesen undifferenzierten Vorläuferzellen können sich differenzierte Zellen bilden. Der Anteil an Stammzellen ist während der embryonalen Phase sehr hoch und nimmt mit zunehmendem Alter kontinuierlich ab. Während des gesamten Lebens sind sie jedoch vorhanden, um beispielsweise Zellen der Haut, der Darmschleimhaut und des Immunsystems zu ersetzen beziehungsweise zu bilden. Außer den Stammzellen sind auch Gameten (Keimzellen) und Krebszellen von der zellulären Seneszenz ausgenommen und können sich – bei Bedarf – beliebig oft teilen.
Außer durch das Erreichen der Hayflick-Grenze kann die zelluläre Seneszenz auch durch nicht mehr reparable Schäden der DNA aktiviert werden. Diese Schäden können beispielsweise durch reaktive Sauerstoffspezies (freie Radikale) entstehen, die zudem auch Lipide (Lipidperoxidation) und Proteine (Proteinoxidation) innerhalb der Zellen angreifen können. Die dabei entstehenden Reaktionsprodukte, wie beispielsweise das Alterspigment Lipofuszin, können oft nur unzureichend abgebaut werden und sammeln sich in der Zelle an. Abhängig vom Ausmaß der Schäden wird die Zelle entweder vorzeitig seneszent oder leitet bei schwereren Schäden – wenn sie noch teilungsfähig ist – die Apoptose ein. Durch diese Maßnahmen wird verhindert, dass sich im Organismus zu viele geschädigte Zellen ansammeln. Der Grund für die beiden Maßnahmen (vorzeitige Seneszenz oder Apoptose) ist – so das vorherrschende Erklärungsmodell –, dass dadurch die Entartung von Zellen und somit die Entstehung von Krebszellen verhindert werden soll. Die Seneszenz wird durch die beiden Proteine p53 („Wächter des Genoms“) und pRB (Retinoblastom-Protein) reguliert. Defekte in den beiden Tumorsuppressorgenen TP53 und RB1, die für p53 beziehungsweise pRB kodieren, können das Seneszenzprogramm und den programmierten Zelltod ausschalten und zu Krebs führen. Folglich sind Zellen, die sowohl das Seneszenzprogramm als auch die Apoptose umgehen können, Krebszellen.
Mäuse, bei denen gezielt die Expression von p53 herunterreguliert wird (Gen-Knockdown), entwickeln dementsprechend sehr leicht spontane Tumoren. Wird bei ihnen dagegen p53 überexprimiert, so wird die Wahrscheinlichkeit einer Krebserkrankung erwartungsgemäß deutlich reduziert. Allerdings ist dies mit dem Effekt verbunden, dass die Lebenserwartung der Tiere durch frühzeitige Alterserscheinungen, wie beispielsweise Osteoporose und universelle Atrophie der Organe, erheblich verkürzt wird.
Aus diesem Sachverhalt schließen einige Forschergruppen, dass das Altern der Preis der weitgehenden Vermeidung von Krebserkrankungen ist.TP53 ist ein streng reguliertes Gen. Sowohl ein Überschuss als auch ein Mangel an p53 sind für den Organismus von Nachteil. p53 hat für den Organismus pleiotrope Eigenschaften: In der Jugend ist es für den Organismus durch die Vermeidung von Krebserkrankungen von Vorteil, später aber durch das schnellere Altern von Nachteil.
Apoptose und zelluläre Veränderungen
Altern kann als Konflikt zwischen dem ‚Individuum‘ Zelle und der ‚Gemeinschaft‘ Organismus aufgefasst werden. Aus Sicht der Evolution ist die langfristige Fortpflanzung des Gesamtorganismus wichtiger als die perfekte Reparatur einer einzelnen Zelle. Der Organismus, das heißt die Mehrzahl der Zellen, wehrt sich mit Hilfe des programmierten Zelltods – der Apoptose – gegen einzelne Zellen, die von der „Norm“ abweichen. Diese Abwehrstrategie ist ein wesentliches Element zum Aufbau eines Organismus aus einem Zellverband.
Zelluläre Seneszenz und Apoptose sind die Werkzeuge, um bösartige Veränderungen in Zellen zu unterdrücken. Auf der anderen Seite sind beide Vorgänge zwangsläufig mit Altern verbunden. Altern ist offensichtlich ein antagonistischer pleiotroper Prozess, um Entartungen von Zellen zu unterdrücken. Die Rolle, die die Apoptose beim Altern spielt, ist noch weitgehend unklar und wird kontrovers diskutiert. Offensichtlich werden während des Alterns signifikante Mengen an Muskelfaserzellen (Myozyten) des Herzmuskels und der Skelettmuskulatur durch Apoptoseprozesse abgebaut. Die Ursache hierfür sind möglicherweise mitochondriale Schäden, beispielsweise durch oxidativen Stress.
Während des Alterns verändert sich das Membranpotenzial, der Lipidanteil und die Fluidität der Zellen. Die Anzahl der Mitochondrien in den Zellen nimmt ab. Diese zellulären Veränderungen lassen sich bei allen Säugetieren feststellen.
Entzündungsaltern
Die vermehrte Ausschüttung von proinflammatorischen Zytokinen bei älteren Menschen wird als Entzündungsaltern (AE: inflammaging) bezeichnet. Diese Ausschüttung führt zu einer leichten systemischen und chronischen Entzündung. Dieser Vorgang wird mit einer Reihe von altersassoziierten Erkrankungen in Verbindung gebracht und wird auch selbst als eine Ursache für das Altern gesehen. Entzündungen sind – so die Hypothese – in jungen Jahren für den Organismus hilfreich, da sie die Überlebenschancen gegen Pathogene erheblich verbessern, aber entsprechend der Theorie der antagonistischen Pleiotropie im Alter für den Organismus eher schädlich. Für diese These spricht, dass durch die Gabe des Immunsuppressivums Rapamycin die Lebenserwartung bei Mäusen signifikant verlängert werden kann.
Aus evolutionärer Sicht ist das Überleben eines Organismus zumindest bis zum Ende seiner reproduktiven Phase wichtig. Die meisten Organismen (einschließlich des Menschen) starben, bevor sie das Ende der Reproduktionsphase erreichten. Die nachteiligen Auswirkungen des Entzündungsalterns traten somit nur sehr selten in Erscheinung. Eine Selektion gegen dieses die Lebensspanne verkürzende und erst nach der Reproduktionsphase auftretende Entzündungsaltern wäre somit nicht möglich.

Evolutionstheorien des Alterns
Im Gegensatz zu proximaten Theorien, wie beispielsweise den Schadenstheorien, die Erklärungsmodelle darüber liefern, wie ein Organismus altert, versuchen die auf der Theorie der Evolution basierenden Theorien des Alterns die Frage nach dem warum zu beantworten (ultimate Theorien). Das Altern ist – diesen Theorien zur Folge – ein Ergebnis des Evolutionsprozesses. Die ersten Lebewesen, die auf der Erde entstanden, alterten nicht. Das Altern entstand im Laufe der Evolution als eine Eigenschaft höherer Lebewesen.
Diese Theorien können eine Reihe von Phänomenen, die im Zusammenhang mit dem Altern stehen, erklären. Auch in verschiedenen Modellorganismen konnten Übereinstimmungen zwischen Theorie und Experiment erhalten werden.
Es gibt derzeit noch keine allgemeine evolutionsbiologische Erklärung für das Altern. Ein Merkmal, das die Lebensdauer begrenzt und zudem die Phase der Fruchtbarkeit limitiert, hat negative Auswirkungen auf die Darwin-Fitness. Selbst Darwin war sich dieses Problems bewusst und nahm an, dass die begrenzte Lebensdauer der höheren Organismen einen Nutzen haben müsse, der den Nachteil des Alterns und des damit verbundenen Sterbens mehr als nur kompensiert. Was dabei der Nutzen ist, konnte Darwin nicht beantworten.
Programmiertes Altern
Die ersten evolutionären Theorien des Alterns wurden unmittelbar nach der Evolutionstheorie im 19. Jahrhundert aufgestellt. Der deutsche Biologe August Weismann sah 1881 im Altern und – als dessen Folge – im Sterben eine Notwendigkeit, die aus der Evolution heraus entstanden sei, weil sie dem Überleben der Art diene. Danach sorgt das Altern dafür, dass die Vorläufergenerationen nicht im Wettbewerb mit ihren Nachkommen um Nahrung und Lebensraum stehen. Die Alten machen sozusagen Platz für die Jungen, damit diese bessere Chancen im „Kampf ums Dasein“ haben. Weismann argumentierte, dass die Unsterblichkeit für ein Individuum nutzlos sei, weil es früher oder später durch einen Unglücksfall oder durch die Ansammlung von nicht vollständig geheilten Verletzungen über die Zeit sowieso getötet werden würde. Gerade Letzteres würde zu älteren Organismen führen, die weniger fit als die jüngeren wären. Die Älteren würden dann den Jüngeren Ressourcen vorenthalten, die besser in die Jüngeren investiert würden. Der Tod alter Organismen infolge von Seneszenz wäre deshalb ein Selektionsvorteil für die Art.
Weismann konnte jedoch keinen darwinistischen Mechanismus für seine These finden. Zudem stellte seine Annahme, dass Organismen keine vollständige Heilung zeigen können, einen Zirkelschluss dar. Tiere einer Art, die in freier Wildbahn als Beutetiere kein fortgeschrittenes Alter erreichen, können in Gefangenschaft verschiedene Alterserscheinungen zeigen, wenn sie die mittlere natürliche Lebensdauer überschritten haben; selbst dann, wenn sie im Verlauf ihrer Evolutionsgeschichte nie die Möglichkeit hatten, diese Alterserscheinungen zu zeigen. Aus diesen Gründen gab Weismann einige Jahre später seine Hypothese wieder auf. Dennoch findet man Weismanns Hypothese auch heute noch in einer Reihe von Veröffentlichungen außerhalb des Fachgebiets der Biogerontologie.
In der Theorie des programmierten Alterns sind Alterungsprozess und Tod notwendige Komponenten der Evolution aber nicht anderweitig biologisch bedingt obligatorisch. Seit Beginn des 21. Jahrhunderts erlebt diese Theorie eine Renaissance. Studien an Modellorganismen wie der Backhefe haben als Ergebnis, dass es zumindest in diesem Einzeller eine Form des ‚programmierten und altruistischen (selbstlosen) Alterns und Sterbens‘ (englisch programmed and altruistic ageing and death) gibt. Wenn etwa 90 bis 99 % der Individuen von Saccharomyces cerevisiae in einer Kultur gestorben sind, entsteht eine kleine mutierte Subpopulation, welche die von den abgestorbenen Zellen freigesetzten Nährstoffe nutzt und sich weiterentwickelt. Zudem wurde festgestellt, dass Hefe-Zellen mit den gleichen Genen auf einem von zwei verschiedenen Wegen altern – nukleolarer oder mitochondrieller Verfall. Wissenschaftler ermittelten den molekularbiologischen Mechanismus, der bestimmt welcher dieser Alterungsprozesse angetreten wird, und erstellten mittels Genmodifizierung für erhöhte Sir2-Expression einen dritten Mechanismus mit deutlich verlängerter Lebensspanne. Da die molekularen Mechanismen, die das Altern kontrollieren, bei vielen Tiermodellen sehr ähnlich sind, besteht die Vermutung, dass das programmierte Altern auch in höheren Eukaryoten vorhanden sein könnte. Als ein Paradebeispiel dient den Verfechtern des programmed ageing dabei der Pazifische Lachs. Mehrere Theorien des programmierten Alterns wurden entwickelt. Einige basieren auf der Gruppenselektion und Verwandtenselektion, andere auf der Evolvierbarkeit. Diese anpassungsabhängigen Theorien (englisch adaptive theories) stehen im Widerspruch zu den nachfolgend behandelten anpassungsunabhängigen Theorien (englisch non-adaptive theories).
Klassische Evolutionstheorien des Alterns

Mit zunehmendem Alter nimmt die natürliche Selektion ab. In freier Wildbahn erreichen durch eine Vielzahl von Faktoren die wenigsten Individuen überhaupt den Bereich des Alterns. Beispielsweise sterben neun von zehn Hausmäusen vor dem zehnten Lebensmonat, während die gleiche Art in Gefangenschaft ein durchschnittliches Alter von 24 Monaten erreicht.
Das Rotkehlchen (Erithacus rubecula) hat eine durchschnittliche Mortalitätsrate von 0,6 pro Jahr. Das heißt, dass 60 % der Tiere pro Jahr sterben. Aus Markierungen und Beobachtungen in der freien Wildbahn konnte man errechnen, dass nur eines von 60.000 Rotkehlchen überhaupt in den Bereich seiner bisher ermittelten maximalen Lebenserwartung von zwölf Jahren kommen kann. Dabei ist noch weitgehend unklar, in welchem Bereich die maximale Lebenserwartung eines Rotkehlchens wirklich liegt. Andere Vögel erreichen mehr als den doppelten Wert, ohne Anzeichen von Seneszenz. Eine lange Lebensdauer bedeutet hohe biologische Kosten, das heißt einen größeren Bedarf an Energie. Die meisten Arten haben deshalb eine lange Lebensdauer gegen eine hohe Reproduktionsrate in jungen Jahren „eingetauscht“. Ihre Fortpflanzung folgt der sogenannten r-Strategie. Das heißt, sie investieren ihre Ressourcen in eine hohe Anzahl von Nachkommen und weniger in eigenes Wachstum und Reparaturmechanismen zur Erhaltung des Somas. Aber auch die – relativ wenigen – Arten, die der K-Strategie folgen, erreichen in der freien Wildbahn in den seltensten Fällen ihre maximale Lebensspanne ω. Schimpansen (Pan troglodytes) werden in Gefangenschaft durchschnittlich 23 (Männchen) und 30 (Weibchen) Jahre alt. 20 % erreichen gar ein Alter von 50 Jahren. Im Gegensatz dazu liegt die Lebenserwartung in freier Wildbahn für die nächsten Verwandten des Menschen bei lediglich acht Jahren, und nahezu kein Exemplar erreicht ein Alter von 50 Jahren. Die Überlebenskurve der ersten Menschen (Homo) war mit der heutiger Schimpansen weitgehend gleich. Eine durch die Selektion begünstigte weitere Investition in Wachstum und vor allem in die Aufrechterhaltung der Homöostase konnte nicht stattfinden – die große Mehrzahl der Individuen starb schon den Katastrophentod, bevor sie in den Bereich des Alterns kam. Generell erreichen bei allen Arten in freier Wildbahn nur sehr wenige Individuen ein Alter, um einen ausreichenden Selektionsdruck gegen das Altern aufzubauen. Man spricht dabei auch von einem Selektionsschatten (englisch selection shadow).
Der Evolutionstheorie zufolge sollten Arten mit einer geringeren Wahrscheinlichkeit eines Katastrophentodes, beispielsweise weil sie kaum Fressfeinde haben, länger leben. Diese Arten hätten genug Zeit zur Entwicklung von Schutzmechanismen zur Aufrechterhaltung der Homöostase, beispielsweise durch den Aufbau antioxidativer Schutzmechanismen in den Zellen oder durch eine bessere Regulation der Expression von Onkogenen. Dies ist unter anderem für Vögel der Fall, die – verglichen mit gleich großen Säugetieren – eine fünf- bis zehnfach höhere Lebenserwartung haben. Gleiches gilt beispielsweise für Fledertiere, Schildkröten und den Menschen. Selbst innerhalb einer Art kann durch den Wegfall von Prädatoren die Evolution in Richtung eines verlangsamten Alterns gelenkt werden. Ein Beispiel hierfür ist das Nordopossum (Didelphis virginiana) in Virginia. Eine seit 4500 Jahren vom Festland abgeschnittene Population dieser Beutelsäuger hat eine deutlich reduzierte Anzahl von Prädatoren. Diese Exemplare altern signifikant langsamer als die Population auf dem Festland.
Der Gedanke des Selektionsschattens wurde zuerst von dem britischen Genetiker J. B. S. Haldane publiziert. In seinem 1942 erschienenen Buch New paths in genetics betrachtete er die Erbkrankheit Chorea Huntington. Aus der Tatsache heraus, dass diese tödlich verlaufende Erkrankung typischerweise erst nach der dritten Lebensdekade auftritt, schloss Haldane, dass sie nur deshalb existiert, weil sie zu den Zeiten unserer Urahnen – noch vor Beginn des Ackerbaus – keinerlei selektiven Effekt auslösen konnte. Weiter postulierte Haldane, dass die natürliche Selektion in späten Lebensabschnitten, typischerweise nach Abschluss der Reproduktionsphase, nur noch eine schwache Kraft sei. Nur wenige Menschen hätten vor Beginn der Zivilisation überhaupt ein Alter von 40 Jahren und mehr erreicht. Ihre genetisch bedingten lebensbedrohlichen Erkrankungen, die erst im Alter zum Ausbruch kamen, konnten keinen Beitrag zur Evolution mittels natürlicher Selektion leisten.
Peter Brian Medawar griff Haldanes Gedanken auf und entwickelte 1952 die Mutations-Akkumulations-Theorie (englisch mutation accumulation theory), nach der sich im Laufe des Lebens eines Organismus schädliche Mutationen anhäufen (akkumulieren), die letztendlich das bewirken, was als Altern wahrgenommen wird. Durch den geringeren Selektionsdruck auf alte Organismen bei Populationen, in denen die meisten Individuen sterben, bevor sie in den Bereich der maximalen Lebenserwartung gelangen, würden sich auch kaum Reparaturmechanismen durchsetzen. Allerdings sei dieser Prozess meist auf die individuelle Entwicklung beschränkt und eine Vererbung solcher Mutationen eher selten.
1957 entwickelte George C. Williams aus den Überlegungen zur Mutations-Akkumulation die Theorie der antagonistischen Pleiotropie. Nach ihr sind antagonistisch pleiotrope Gene für das Altern von Organismen verantwortlich, die sich geschlechtlich fortpflanzen. Pleiotrop sind Gene, die unter verschiedenen Bedingungen auch verschiedene Erscheinungsbilder verursachen. Antagonistisch (entgegengesetzt) bedeutet in diesem Zusammenhang, dass einige pleiotrope Gene unter den Bedingungen in einem jungen Organismus für die Fortpflanzung förderliche, aber unter den Bedingungen in demselben, gealterten Organismus schädliche Wirkungen haben – worin diese Theorie den Grund des Alterns sieht. Da die schädlichen Wirkungen solcher Gene häufiger erst nach der Zeugung von Nachkommen und damit Weitergabe der Gene auftreten, haben sie nur geringe negative Auswirkungen auf den Fortpflanzungserfolg ihrer Träger. Schädliche Mutationen, die erst im Alter ihre Wirkung zeigen, häufen sich nach Williams daher im Genom eines Organismus vermehrt an, wenn diese Mutationen dem Organismus in einem frühen Lebensabschnitt Fortpflanzungs-Vorteile verschaffen. Der Begriff antagonistische Pleiotropie wurde 1982 von Michael R. Rose geprägt.
William D. Hamilton formulierte die Theorie um. Wenn Organismen altern, so sinkt ihr Beitrag zur Fortpflanzung, da ihre Fertilität mit der Zeit abnimmt. Die Selektion führt daher bei älteren Organismen zu höheren Mortalitätsraten. Ohne diese Unterschiede bei der Fruchtbarkeit zwischen jungen und alten Organismen gäbe es von Seiten der Evolution keinen Grund, warum Organismen altern und somit beispielsweise leichter lebensverkürzende Krankheiten bekommen. Diesen Überlegungen widerspricht jedoch die Beobachtung, dass manche Lebewesen – insbesondere der Mensch – sich auch nach Abschluss ihrer Reproduktionsphase, wenn sie keinen unmittelbaren Beitrag zur Fortpflanzung leisten können, bester Gesundheit erfreuen können. Dieser Sachverhalt lässt sich dadurch erklären, dass viele Lebewesen nicht nur in die Geburt, sondern auch in die Aufzucht ihres Nachwuchses investieren. Die Investitionen können auch in die Enkelgeneration erfolgen (siehe auch Großmutter-Hypothese). Beim Großen Tümmler (Tursiops truncatus) beispielsweise beaufsichtigen, beschützen und säugen die Großeltern ihre Enkel.
Die 1977 von Tom Kirkwood aufgestellte Disposable-Soma-Theorie basiert auf den beiden von Medawar und Williams aufgestellten Theorien. Zusätzlich kommen noch Aspekte der Life-history-Theorie hinzu. Prinzipiell verfügt jeder Organismus über Reparaturmechanismen. Einige Arten, wie beispielsweise der mexikanische Schwanzlurch Axolotl (Ambystoma mexicanum), sind in der Lage verlorene Körperteile vollständig wiederherzustellen. Es würde gegen keine Naturgesetz verstoßen, wenn ein höherer Organismus – wie beispielsweise der Mensch – gealterte, degenerierte Zellen oder ganze Organe vollständig ersetzen könnte und so potenziell unsterblich wäre. Solche Mechanismen sind teilweise vorhanden, aber in ihrer Funktion, insbesondere mit zunehmendem Alter, unzureichend. Auf den ersten Blick müsste ein solcher Organismus von der Evolution bevorzugt sein. Er ist es aber nicht. Es ist eher genau das Gegenteil der Fall. Jedem Organismus stehen nur begrenzte Ressourcen zu Verfügung. Diese muss er gemäß der Life-history-Theorie aufteilen in:
- eigenes Wachstum
- Selbsterhaltung
- Fortpflanzung
Jede Investition in einen dieser konkurrierenden Prozesse bedeutet eine Verknappung der Ressourcen bei einem der beiden anderen Prozesse (trade-off genannt, engl. für ‚Zielkonflikt‘). Jeder Organismus passt seine Lebenszyklusstrategie an die Menge und Verteilung der verfügbaren Ressourcen in seinem Habitat an. Dabei existiert eine große Vielfalt an Lebenszyklusstrategien. Der Körper (das Soma) hält den Aufwand für die Selbsterhaltung auf einem Niveau, das gerade hoch genug ist, um für die normale Lebenserwartung in freier Wildbahn in einem guten Zustand zu sein – und die beiden anderen Prozesse nicht zu kurz kommen zu lassen –, aber nicht so hoch, dass er ohne sicheren Tod leben kann. Das Soma ist nach Kirkwood disposable, das heißt, es gibt keine Notwendigkeit zu einer genetischen Optimierung.
Eine Reihe von Beobachtungen an verschiedenen Spezies bestätigen die Evolutionstheorien des Alterns, insbesondere die Theorie der Antagonistischen Pleiotropie und die Disposable-Soma-Theorie; so beispielsweise Experimente mit dem Modellorganismus Drosophila melanogaster in den 1980er Jahren.
Für in freier Wildbahn lebende Spezies gibt es noch relativ wenige Daten, die eine Überprüfung der Theorien ermöglichen. Bis 2008 waren bei lediglich fünf in freier Wildbahn lebenden Wirbeltierarten die dem Alternsprozess zugrunde liegenden Mechanismen untersucht worden. Beispielsweise konnten bei der Trottellumme (Uria aalge), dem Höckerschwan (Cygnus olor), der Kegelrobbe (Halichoerus grypus) und dem Rothirsch (Cervus elaphus) Übereinstimmungen zu den Vorhersagen der Evolutionstheorien des Alterns gefunden werden. Als freilebende Wirbeltiere eignen sich besonders Vögel.
Die Überlebenskurven aller Lebewesen in freier Wildbahn zeigen, dass der Katastrophentod – beispielsweise durch Prädatoren, Krankheiten oder sich dramatisch ändernde Lebensbedingungen – der Normalfall ist. Eine Investition in eine potenzielle Unsterblichkeit wäre unter diesen Bedingungen eine Fehlinvestition. Für das Überleben der Art ist die Investition in eigenes Wachstum – beispielsweise um weniger Prädatoren zu haben – oder in mehr Nachkommen die bessere Anlage von Ressourcen. Die Überlebenskurve vieler Menschen weicht erst seit einem evolutionsgeschichtlich unbedeutend kurzen Zeitraum von der anderer Arten in freier Wildbahn ab. In diesem kurzen Zeitraum konnten durch natürliche Selektion keine grundlegenden Änderungen in der Lebenszyklusstrategie stattfinden.
Geschlechtsunterschiede beim Altern

Bei den meisten Säugetieren, einschließlich des Menschen, und Insekten ist die Lebenserwartung der Männchen signifikant kürzer als die der Weibchen.
Beim Menschen beträgt der Unterschied in der Lebenserwartung zwischen den Geschlechtern – je nach Land – zwischen sechs und acht Jahren. Um Rückschlüsse auf ein biologisch bedingt unterschiedliches Altern der Geschlechter zu schließen, müssen weitere Einflussfaktoren erfasst und herausgerechnet werden, also nicht-biologisch-bedingte Unterschiede zwischen den Geschlechtern, die sich lebensverkürzend auswirken (etwa Rauch-, Trinkverhalten, Unfalltod im Straßenverkehr, Tod durch Kriegseinsätze). Dieser Umstand wird in nichtwissenschaftlichen Publikationen selten berücksichtigt, so dass oft allein anhand der Sterberate gefolgert wird, dass Männer schneller dem Alterstod erliegen als Frauen. Wissenschaftliche Aufbereitungen zum Thema jedoch kommen auf unterschiedliche Ergebnisse: Laut L. Mealey ist die durchschnittlich geringere Lebenserwartung der Männer tatsächlich zu einem Großteil durch unterschiedliche Raten beim Altern und eine früher eintretende und progressivere Seneszenz verursacht. Andere Studien hingegen legen als Ursache für die kürzere Lebenserwartung der Männer geschlechtsbezogene Unterschiede in der Lebensführung nahe, die auch mit den regionalen Unterschieden der alters- und geschlechtsbezogenen Sterberate korrelieren.
Bei den meisten Vogel-Taxa verhält es sich umgekehrt als beim Großteil der Säugetiere und Insekten: Hier werden die meisten Männchen älter als die Weibchen.
Die Ursachen für die Geschlechtsunterschiede beim Altern bei den genannten zoologischen Klassen sind offensichtlich von mehreren Faktoren abhängig. Es wurden verschiedene Erklärungsmodelle für dieses noch weitgehend ungeklärte Phänomen aufgestellt.
Asymmetrische Vererbungsmuster
Einige Theorien zur Erklärung des Phänomens basieren auf asymmetrischen Vererbungsmustern. So die unguarded X-hypothesis („Hypothese vom ungeschützten X-Chromosom“). Männliche Säugetiere sind hemizygot, das heißt, sie tragen zwei unterschiedliche Geschlechtschromosomen (X und Y). Die Weibchen sind dagegen homozygot. Sie sind mit zwei identischen Geschlechtschromosomen (X und X) ausgestattet. Bei Männchen ist somit nur ein X-Chromosom vorhanden (das „ungeschützte X-Chromosom“), während bei Weibchen das X-Chromosom redundant ist. Nachteilige Mutationen auf dem X-Chromosom kommen daher bei Männchen in jedem Fall zur Wirkung, was sich – so die Hypothese – in einer höheren Mortalitätsrate äußern sollte. Es gibt bisher keine experimentelle Verifikation oder Falsifikation der Hypothese. Sie stimmt aber mit der Beobachtung überein, dass bei den meisten Vogel-Taxa die Männchen eine höhere Lebenserwartung haben, da bei Vögeln die Männchen homozygot (Z + Z) und die Weibchen hemizygot (Z + W) sind.
Eine andere Hypothese basiert auf einem asymmetrischen Vererbungsmuster der mitochondrialen DNA, die bei den meisten Organismen nur von der Mutter an die Nachkommen vererbt wird. Dieses Genom wird folglich nur bei den Weibchen selektiert und so weiter optimiert. Es kann daher – so die Hypothese – unter Umständen bei Männchen suboptimale Eigenschaften entfalten, die zu einer erhöhten Mortalität führen. Die Mitochondrien spielen beim Altern eine aktive Rolle. Sie haben unmittelbaren Einfluss auf die Mortalitätsrate und die maximale Lebensspanne, was zu dieser Hypothese passt. Allerdings lässt sich nicht erklären, warum bei vielen Vogelarten Männchen länger als Weibchen leben.
Evolutionäre Hypothesen
Bei der sexuellen Selektion werden Männchen durch Weibchen derselben Art erwählt und erhalten dadurch einen Vorteil gegenüber ihren Geschlechtsgenossen bei der Fortpflanzung. Dies kann auf Kosten anderer Funktionen, wie beispielsweise der Selbsterhaltung des Somas, geschehen. Pleiotrope Gene, die den Männchen für die Reproduktion Vorteile verschaffen, sich aber im fortgeschrittenen Alter eher negativ auswirken, sind ein anderes evolutionäres Erklärungsmodell.
Ein weiteres evolutionäres Erklärungsmodell geht dabei davon aus, dass bei polygynen Arten zwischen den Männchen ein erbitterter Wettbewerb um die Weibchen herrscht. Dies wirkt sich unmittelbar auf Wachstum und Verhalten der Männchen aus, die mehr Ressourcen in Paarungsstrategien investieren, beispielsweise um einen Wettbewerbsvorteil gegenüber anderen Männchen zu haben oder um Wettbewerber von ihrem Weibchen fernzuhalten. Der Selektionsdruck sollte daher bei Männchen höher als bei Weibchen sein, was sich in höheren Mortalitätsraten über die meiste Zeit ihrer Lebensspanne niederschlägt. Bei monogamen Arten sollte zwischen den Geschlechtern der Unterschied im Altern, und daraus abgeleitet der mittleren Lebenserwartung, geringer sein. Bei dem Vergleich zwischen sechs monogamen mit sechs polygynen Arten konnten überzeugende Indizien für diese Hypothese gefunden werden.
Alternspsychologie
Die physischen und psychischen Aspekte des Alterns verlaufen nicht zwingend synchron. Körperliche degenerative Prozesse können mitunter zeitgleich mit einer Zunahme mentaler Agilität stattfinden. Parallel zu einem möglichen Rückgang der Gedächtnisleistung (fluide Intelligenz) können davon weitgehend unbeeinflusste klare Reflexionsleistungen (kristalline Intelligenz) beobachtet werden. Insgesamt zeigt sich der Alternsprozess in einer Verlangsamung der vom ZNS gesteuerten Verhaltensreaktionen und kann individuell sehr unterschiedlich verlaufen.
Veränderung kognitiver Fähigkeiten
Kognitiv-mentale Fähigkeiten zur Verarbeitung von Informationen sind unweigerlich mit dem Erleben und dem Verhalten des Menschen verbunden. Es wird angenommen, dass die unterschiedlichen kognitiven Fähigkeiten unterschiedlichen Alternsprozessen unterliegen. So haben Untersuchungen gezeigt, dass die kristalline Intelligenz (zum Beispiel der Wortschatz) bis ins Alter stabil bleibt oder sich sogar weiterentwickelt, wohingegen bei der fluiden Intelligenz (zum Beispiel das Arbeitsgedächtnis) mit zunehmendem Alter ein Abbau zu beobachten ist.
Folgende Veränderungen im kognitiven Bereich können auftreten:
| Kognitive Fähigkeit | Veränderungsprozess |
|---|---|
| Informationsaufnahme und -verarbeitung | Nachlassende Aufnahme- und Verarbeitungsgeschwindigkeit (Zunahme der Verzögerungen in der Encodierung und Verarbeitung der Information, und in der Selektion einer Reaktion) |
| Abnehmende Informationsverarbeitungskapazität (Abnahme der Menge an Information, die gleichzeitig aufgenommen und verarbeitet werden kann) | |
| Reaktion | Nachlassende Reaktionsgeschwindigkeit bereits ab 20. Lebensjahr durch abnehmende Geschwindigkeit bei der Übertragung von Nervenimpulsen und der Informationsverarbeitung |
| Erhöhte Störempfindlichkeit bei Reizüberflutung, Ablenkungen und Irritationen | |
| Koordination | Das gleichzeitige oder schnelle hintereinander Verrichten von Aufgaben fällt zunehmend schwer aufgrund verminderten Informationsverarbeitungskapazität und Reaktionsgeschwindigkeit |
| Gedächtnisleistung | Nachlassendes KZG sowie LZG, etwa bei episodischer Erinnerung, semantischer Erinnerung (z. B. Namen) |
| Weniger effiziente und spontane Nutzung von Mnemotechniken (z. B. „Eselsbrücken“) | |
| Langsamere und ineffektivere Dekodierungsprozesse (Längere Dauer, Informationen aus dem Gedächtnis zu holen, Zunahme der Störungsanfälligkeit durch Ablenkung und Unterbrechungen) | |
| Lernen | Längere Lernzeiten durch Verlangsamung der Informationsverarbeitung, einmal Gelerntes kann aber genauso gut behalten werden wie bei Jüngeren |
| Abnehmende Lernfähigkeit bei bestimmten Lerninhalten: Größere Schwierigkeiten bei Erlernen neuer Schemata (die nicht auf existierendes Wissen aufbauen oder der Erwartung entsprechen) als bei Jüngeren |
Faktoren wie Genetik, Ernährung, Stressbelastung sowie physiologische und mentale Fitness können den kognitiven Alterungsprozess verlangsamen.
Die Genetik an sich ist weitgehend festgelegt und definiert somit eine Obergrenze der kognitiven Leistungsfähigkeit. Die Epigenetik bietet jedoch Möglichkeiten, den genetisch festgesetzten Rahmen bestmöglich auszuschöpfen. So konnte in Studien mit Mikroorganismen z. B. gezeigt werden, dass kalorische Restriktion einen positiven Effekt auf den Insulinstoffwechsel hat.
Die Prozesse sind unterschiedlich fortschreitend und können aktiv verlangsamt werden. Durch gezieltes Training („Gehirnjogging“) sowie körperliche Bewegung lassen sich auch im Alter kognitive Leistungsreserven mobilisieren.
Mit ihren Forschungsergebnissen wiesen Brand und Markowitsch dem präfrontalen Cortex eine „Schlüsselrolle für den altersbedingten Abbau kognitiver Leistungen zu, weil er einerseits von Bedeutung für diverse Gedächtnisfunktionen ist und andererseits zentral exekutive Funktionen steuert, die wiederum auf Gedächtnisleistungen zurückwirken“.
Eine Studie weist darauf hin, dass nicht nur die Fitness, sondern auch die kognitive Leistungsfähigkeit im Zusammenhang mit der Lungengesundheit steht. Über 19 Jahre wurden 832 Testpersonen beobachtet. Es wurden Lungenfunktionstests sowie kognitive Tests durchgeführt. Die Ergebnisse wurden miteinander verglichen. Während eine schlechtere Lungenfunktion keinen Einfluss auf die Erinnerung zu haben scheint, beeinflusst sie sehr wohl die Fähigkeiten der Problemlösung und der Verarbeitungsgeschwindigkeit. Einen expliziten Grund für diesen Zusammenhang konnten die Forscher noch nicht finden.
Die allgemein verbreitete Annahme höherer Kompetenz im Umgang mit sozialen Konflikten als Teil einer „Altersweisheit“ wird empirisch gestützt: Im Rahmen einer Studie des Psychologen Igor Grossmann et al. bedienten sich ältere Probanden im Vergleich zu solchen jungen und mittleren Alters in größerem Umfang weiterentwickelter Schemata bei der Analyse von Konfliktsituationen, die mehrere Blickwinkel berücksichtigen, Kompromisse ermöglichen und die Grenzen des Wissens anerkennen.
Entwicklungspsychologische Aspekte
Die Entwicklungsmöglichkeiten der Persönlichkeit sind von äußeren Bedingungen wie Lebensalter, -abschnitt, Gesundheit und Krankheit weitgehend unabhängig. Entwicklungspsychologisch stellt Altern die Wechselwirkung dar zwischen Regression auf der einen Seite und der Entwicklung und Stabilisierung von Persönlichkeits- und Leistungsmerkmalen auf der anderen Seite.
Sozialpsychologische Aspekte
Die Rolle des alten Menschen in der Gesellschaft ist stark im Wandel durch die Zunahme des durchschnittlichen Lebensalters und den rückläufigen Geburtenraten der meisten westlichen Industriestaaten. Infolge dieser Verschiebung der Proportionen verändert sich das Verhältnis der Generationen zueinander und ihr jeweiliges Rollenverständnis. Insgesamt ist die Präsenz älterer Menschen und deren Selbstbewusstsein in der Gesellschaft gestiegen. Das zeigt sich etwa in vermehrten Freizeitangeboten für Senioren wie in der öffentlichen Thematisierung des langzeitigen Tabuthemas Sexualität im Alter.
Die Angst vor dem Altern erweist sich empirisch als bedeutender individueller bestimmender Faktor für Ageism.
Klinisch-psychologische Aspekte
Mit zunehmender Lebensdauer nimmt auch die Anzahl einschneidender Lebensereignisse zu. Zu den kritischsten gehört der Tod des Lebenspartners. Parallel verändern sich die Lebensperspektiven im Alter hinsichtlich Lebensdauer, Gesundheit, sozialer Einbindung, Mobilität etc. Diese Umstände stellen erhöhte Ansprüche an die Fähigkeit, solche Ereignisse zu verarbeiten. Der Gerontopsychiater Hartmut Radebold wies auf die klinische Bedeutung des traumatischen Charakters der Häufung bedrohlicher Verluste, narzisstischer Kränkungen und Attacken (Vorwürfe, Einengungen, Gewalt) in dieser Lebensphase hin. Die häufigste psychische Erkrankung des Alters ist die Depression, weswegen bisweilen von „Altersdepression“ die Rede ist. Der Erhalt von sinnstiftenden Tätigkeiten und die Pflege sozialer Kontakte spielen eine zentrale Rolle, die Krisen zu überwinden.
Mit zunehmendem Alter haben viele Menschen ein Bedürfnis, über ihr Leben nachzudenken, es so wertzuschätzen, wie es verlaufen ist, und es als sinnvoll zu verstehen. Ein Lebensrückblick, der mit dem eigenen Leben versöhnt, kann u. a. in einer Lebensrückblickstherapie erreicht werden (Maercker & Forstmeier 2013).
Weitere mentale Aspekte zur Förderung der Gesundheit im Alter und zur Erhaltung der möglichen Lebenserwartung finden sich im nächsten Kapitel „Maßnahmen gegen das Altern: Mentale Einflüsse“.
Maßnahmen gegen das Altern
Die oft mit den Worten Jeder möchte alt werden, doch keiner möchte alt sein beschriebene Situation des Alterns speziell beim Menschen ist die Basis für einen ganzen Wirtschaftszweig: Anti-Aging. Viele der Ratschläge fokussieren sich auf eine möglichst gesunde und zufriedene Lebensweise.
Bei den Maßnahmen gegen das Altern muss zwischen primärem und sekundärem Altern unterschieden werden. Durch eine Reihe von Verhaltensregeln, wie beispielsweise gesunde ausgewogene Ernährung, Verzicht auf Tabakkonsum und regelmäßige Bewegung, kann das sekundäre Altern beim Menschen minimiert werden.
Viele Ergebnisse aus Tierversuchen sind kaum auf den Menschen übertragbar. Menschliche Alternsprozesse, die über viele Jahrzehnte ablaufen, lassen sich nur unzureichend mit Organismen abbilden, die erheblich kürzere Lebenserwartungen haben. Kontrollierte klinische Studien, idealerweise Doppelblindstudien, am Menschen sind kaum oder nur sehr aufwändig durchzuführen. Sie müssten über Jahrzehnte mit statistisch ausreichend großen Populationen durchgeführt werden. Ethische Bedenken, extrem hohe Kosten und Risiken stehen einer Erprobung im Weg. Nebenwirkungen eines Anti-Aging-Mittels, das gesunde Menschen über viele Jahrzehnte einnehmen müssten, würden nicht toleriert werden und einer Zulassung entgegenstehen.
Eine Verlängerung der Lebensspanne erscheint vielen Menschen nur dann als sinnvoll, wenn auch die Lebensqualität für den gewonnenen Zeitraum entsprechend hoch ist. In diesem Zusammenhang ist etwa von gesundem oder erfolgreichem Altern die Rede.
Kalorienrestriktion
In einer Vielzahl von Modellorganismen konnte nachgewiesen werden, dass das primäre Altern durch eine erhebliche Reduzierung der Nahrungsaufnahme (Kalorienrestriktion) verzögert werden kann. Die Kalorienrestriktion erhöht die mittlere und die maximale Lebenserwartung. Altersassoziierte Krankheiten werden abgeschwächt beziehungsweise verzögert. Ein Nachweis, dass die Kalorienrestriktion auch bei Primaten das primäre Altern verzögert und die Lebenserwartung erhöht, steht noch aus. Mehrere Studien mit Rhesusaffen brachten insgesamt widersprüchliche Ergebnisse. Beim Menschen deuten die Laborergebnisse für die wichtigsten Biomarker bei Probanden, die mit einer Kalorienrestriktion leben, darauf hin. Die für eine Kalorienrestriktion erforderliche Askese ist allerdings für die meisten Menschen nicht praktikabel.
Die genauen Ursachen für die lebensverlängernde Wirkung der Kalorienrestriktion sind noch nicht endgültig geklärt. Fest steht, dass weder die katabolische Rate pro Kilogramm Körpermasse, noch die Menge an freien Radikalen reduziert wird. Beides Indizien dafür, dass die Mechanismen aus den Schadenstheorien in diesem Fall keine Rolle spielen. Ein Erklärungsmodell liefert aus evolutionärer Sicht die Disposable-Soma-Theorie. Die Kalorienrestriktion bewirkt im Organismus eine Verschiebung der r-/K-Strategie in Richtung der Selbsterhaltung auf Kosten reduzierter Fortpflanzung. Die äußere Bedingung wenig Nahrung ist ein Signal dafür, dass eine Fortpflanzung zu diesem Zeitpunkt ungünstig ist. Um diesen Zeitraum des Nahrungsmangels zu überbrücken, darf sich der Organismus nur wenig verändern (altern), um sich später noch fortpflanzen zu können. Der durch das Hungern ausgelöste Stress führt über das Eigennutzprinzip der Zellen zu einer aktiven Anpassung. Die Stressantwort der Zellen kann über eine veränderte Genexpression nachgewiesen werden. Zu den vermehrt exprimierten Genen gehören unter anderem die Hitzeschockproteine (HSP) aus der Familie der Hsp70 und Sirtuin-1. Auf der anderen Seite ist eine verminderte Expression von pro-inflammatorischen Genen nachweisbar.
Auch beim intermittierenden Fasten, bei dem die Gesamtnährstoffaufnahme über die Zeit nicht reduziert sein muss und das Körpergewicht gehalten wird, lässt sich bei einer Reihe von Modellorganismen eine höhere Lebenserwartung und eine geringere Rate an altersbedingten Erkrankungen beobachten.
Wirkstoffe

Das Altern ist nach Maßgabe der Food and Drug Administration keine Krankheit. Dies hat zur Folge, dass neue Wirkstoffe, die potenziell gegen das Altern wirksam wären, derzeit nur dann eine Chance zur Zulassung haben, wenn sie eine Wirksamkeit (Therapie) beziehungsweise eine vorbeugende Wirkung (Prävention) gegen Krankheiten zeigen. Es gibt derzeit kein gegen das Altern wirksames zugelassenes Arzneimittel. Für keine Substanz wurde – unabhängig vom Zulassungsstatus – bisher der wissenschaftliche Nachweis erbracht, dass sie beim Menschen das Altern verzögern oder gar stoppen kann. Unabhängig davon hat sich ein grauer Markt mit unseriösen Heilsversprechungen für eine Reihe von potenziellen, aber auch nachgewiesen unwirksamen oder gar nachteiligen Substanzen entwickelt. Beispiele sind die „Anti-Aging-Hormone“ Dehydroepiandrosteron (DHEA), Testosteron, Somatotropin und Melatonin. Die vermeintlich positiven Wirkungen begründen sich in den meisten Fällen nur auf der Beobachtung, dass die Spiegel bestimmter Hormone mit zunehmendem Alter immer weiter absinken und – als mutmaßlich logischer Schluss daraus –, dass ein Hormonersatz einen jugendlichen Zustand bewirken könne. Dabei ist in vielen Fällen die Beziehung von Ursache-Wirkung unklar: Ist die nachlassende Hormonausschüttung eine Folge des Alterns und daher möglicherweise ein sinnvoller physiologischer Vorgang oder bewirken die sinkenden Hormonspiegel das Altern? Die Diskussion über die Gabe von Hormonen im Alter ist sehr kontrovers. Siehe dazu auch Hormonersatztherapie.
Für alle Wirkstoffe auf Hormonbasis fehlt bis heute der Nachweis einer Wirksamkeit gegen das Altern beim Menschen.
Eine 2011 veröffentlichten Studie von Michael Ristow legt einen Zusammenhang zwischen einer erhöhten Aufnahme des Spurenelements Lithium und einer niedrigeren Sterblichkeit nahe. In einer Untersuchung in Japan wurde in Gegenden mit vergleichsweise hohem Vorkommen des Elements im Trinkwasser gegenüber der allgemeinen Lebenserwartung eine deutlich höhere festgestellt. Im Laborexperiment wurde beim Fadenwurm Caenorhabditis elegans nach der Behandlung mit einer äquivalenten Dosierung des Spurenelements ebenfalls eine Erhöhung der durchschnittlichen Lebenserwartung nachgewiesen. Dies liefert erste Anhaltspunkte für einen möglichen Zusammenhang auch beim Menschen, allerdings noch keine Schlussfolgerung.
Gentechnische Ansätze
Die Molekularbiologie hat mit der Entschlüsselung des menschlichen Genoms zu Beginn des 21. Jahrhunderts erhebliche Fortschritte gemacht. Dabei wurden auch Gene identifiziert, die unmittelbar an den Vorgängen des Alterns beteiligt sind. Es ist derzeit nicht abzusehen, wann und wie sich das Altern zukünftig durch molekularbiologische Interventionen beeinflussen lässt. Welche Potenziale dabei prinzipiell bestehen konnte an Modellorganismen, wie beispielsweise den Dwarf-Mäusen oder Caenorhabditis elegans, gezeigt werden.
Mentale Einflüsse
1979 startete die amerikanische Sozialpsychologin Ellen J. Langer ein Experiment, bei dem Männer zwischen Ende 70 und Anfang 80 Jahren sich eine Woche lang in eine simulierte Umgebung von 1959 begaben. Eine Gruppe hatte zudem den Auftrag, sich aktiv in diese Zeit und das, was sie damals bewegte, hineinzuversetzen – alle Ereignisse nach 1959 sollten thematisch tabu sein. Das Ergebnis war insofern erstaunlich, als sich sowohl mentale als sogar auch körperlich manifestiert erscheinende Fähigkeiten wie etwa Sehkraft und Beweglichkeit der Gelenke verbessert hatten; und zwar besonders deutlich bei der Gruppe, die sich aktiv mit ihrem Leben während dieser Zeit auseinandergesetzt hatte. Möglicherweise hatte das zeitliche Zurückversetzen und die Sicht auf das jüngere Selbst die Selbstwirksamkeitserwartung – also die Erwartung, bestimmte Dinge machen zu können – der Teilnehmer erhöht und diese positiven Effekte gefördert. Diese und weitere Ergebnisse dazu sind u. a. Gegenstand eines 2010 erschienenen Fachartikels des Magazins Perspectives on Psychological Science und wurden in mehreren populärwissenschaftlichen Abhandlungen aufgegriffen.
Die Epidemiologin und Sozialmedizinerin Becca R. Levy von der Yale University wertete die Lebensspanne von 650 Menschen aus, die 1979 in einer Umfrage gebeten worden waren, positive oder negative Aussagen zum Thema Alter als zutreffend anzukreuzen. Über 20 Jahre später ergab die Analyse, dass diejenigen, die das Altern tendenziell positiv betrachteten, im Durchschnitt 7,5 Jahre länger lebten als jene, die eine negative Haltung zeigten.
Das Altern aus medizingeschichtlicher Sicht
Das Interesse am Altern und der Kampf gegen seine negativen Auswirkungen dürfte fast so alt wie die Menschheit selbst sein. Fulgentius (Mythographus) entnahm in „sermones antiqui“ dem Geschichtswerk des Cincius Alimentus dessen Zitat des Gorgias: „Wer als Tattergreis das Ende seiner Tage herbeisehnte, der entrönne, wenn schon nicht dem Tod, doch wenigstens der Gebrechlichkeit.“ Der Text des Cincius ist die erste überlieferte schriftliche Auseinandersetzung mit dem Alter im lateinischen Kulturkreis. Als Nächstes ist erst wieder Lucilius zu nennen und dann Juvenal.
Der Erhalt der Jugend, Lebensverlängerung oder gar Ewiges Leben sind uralte Menschheitsträume, die sich in einer Vielzahl mythischer oder religiöser Überlieferungen wiederfinden.
Die Überlieferungen handeln beispielsweise von Jungbrunnen als Quelle der Ewigen Jugend oder des Ewigen Lebens. Ein Kraut, das Ewiges Leben spendet, wurde vom Gilgamesch im gleichnamigen Epos um 3000 vor Christus gesucht. Die goldenen Äpfel der Hesperiden verliehen den Göttern der Griechischen Mythologie die Ewige Jugend. Tithonos wurde zwar auf Bitten von Eos das Ewige Leben durch Zeus gewährt, allerdings vergaß Eos auch um die Ewige Jugend zu bitten, so dass Tithonos alterte und bis zu einer Zikade schrumpfte. Dieses Thema wurde später von Jonathan Swift in Gullivers Reisen mit den unsterblichen Struldbrugs aufgegriffen und variiert.
Das 1. Buch Mose im Alten Testament berichtet von dem Baum des Lebens, zu dessen Früchten Adam und Eva nach der Vertreibung aus dem Paradies – sie hatten zuvor verbotenerweise von den Früchten des Baumes der Erkenntnis gegessen – keinen Zugang mehr hatten. Dies ist ein früher religiöser Erklärungsansatz für die Sterblichkeit des Menschen. Die Genesis liefert auch einen Hinweis auf die maximale Lebensspanne des Menschen:
„Da sprach der Herr: Mein Geist soll nicht für immer im Menschen bleiben, weil er auch Fleisch ist; daher soll seine Lebenszeit 120 Jahre betragen.“
Im Papyrus Edwin Smith werden Rezepturen gegen Altersflecken und Falten der Haut beschrieben. Bei Hippokrates von Kos, Aristoteles und Galenos finden sich Altersprophylaxen in Form von Diät und Mäßigung. Aristoteles versucht dabei das Aufzehren der „inneren Wärme“, die für ihn das Leben darstellt, zu verhindern oder zumindest zu verzögern. Galenos begründete die Gerokomie (medizinische Behandlung der Alten) und sorgte so für Alten- und Pflegeheime im römischen Konstantinopel. Bis in die Neuzeit hinein waren die Auffassungen darüber, ob Altern eine Krankheit sei, sehr kontrovers. Für Aristoteles war Altern eine natürliche Krankheit und für Seneca gar eine unheilbare. Terenz meinte Senectus ipsa morbus (est), dt. ‚das Alter selbst ist eine Krankheit‘. Für Galenus war das Altern keine Krankheit, da er Krankheit als wider die Natur betrachtete. Paracelsus sah im 16. Jahrhundert im Altern eine Selbstvergiftung. Ignatz Leo Nascher, der Vater der modernen Geriatrie, betonte stets, dass Altern keine Krankheit sei.
Bis in die Renaissance versuchte man mit Sunamitismus die männliche Altersschwäche zu therapieren. Dabei sollten die körperlichen „Ausdünstungen“ einer Jungfrau, die zu dem behandelten Greis ins Bett gelegt wurde – ohne dass dabei Geschlechtsverkehr stattfand –, verjüngend wirken. Diese Form der Therapie geht auf das Alte Testament zurück.
Gegen Ende des 18. Jahrhunderts begründete der deutsche Arzt Christoph Wilhelm Hufeland die Makrobiotik. Sein 1796 erschienenes Buch Makrobiotik oder Die Kunst das menschliche Leben zu verlängern wurde ein Welterfolg.
Bis in das 20. Jahrhundert hinein gingen einige Ärzte noch davon aus, dass das Altern vor allem durch eine „Rückbildung der Geschlechtsdrüsen“ verursacht werde. Dies führte in einigen Fällen zu heute abstrus erscheinenden „Therapieansätzen“, wie beispielsweise injizierten Hodenextrakten verschiedener Spezies. Charles-Édouard Brown-Séquard arbeitete gegen Ende des 19. Jahrhunderts mit subkutanen Injektionen von Hoden-Extrakten von Meerschweinchen und Hunden, dem sogenannten Brown-Séquard-Elixier, mit dem er auch sich selbst „verjüngt“ hatte.Serge Voronoff implantierte am 12. Juni 1920 erstmals in das Skrotum eines Patienten in Scheiben geschnittene Hoden eines Schimpansen. Die dünnen Scheiben sollten dabei die Vereinigung des Xenografts mit dem Gewebe des Patienten fördern. Weltweit ging die Zahl dieser Eingriffe in die Tausende. In Österreich arbeitete Eugen Steinach an einer Variante von Vornoffs Transplantationen. Später transplantierte Voronoff auch Affenovarien (erfolglos) in Frauen, um die Menopause zu verhindern. Als sich die von Voronoff versprochenen Wirkungen bei den Patienten nicht einstellten – die kurzzeitig beobachteten Erfolge werden heute im Wesentlichen dem Placebo-Effekt zugesprochen – geriet Vornoffs Transplantationsmethode aus der Mode. Als wenige Jahre später das Testosteron als die aktive Substanz der Hoden identifiziert wurde, keimten die Hoffnungen zur Revitalisierung und Verjüngung des Mannes wieder auf. Die erhoffte Wirkung stellte sich aber nicht ein. Testosteron verlängerte nicht die Lebenserwartung der Versuchstiere. Durch die pleiotrope Wirkung des Testosterons ist eher das Gegenteil der Fall.
Einen ähnlichen Weg ging der Schweizer Arzt Paul Niehans, der 1931 mit Zellsuspensionen von Schaf-Feten die sogenannte ‚Zellulartherapie‘ (Frischzellentherapie) erfand. Das Verfahren hatte bis in die 1980er Jahre eine gewisse Verbreitung und fand vor allem durch die Behandlung zahlreicher Prominenter, wie beispielsweise Konrad Adenauer, Pius XII. und Hirohito, in der Boulevardpresse Beachtung. Für die Wirksamkeit der Frischzellentherapie liegt bis heute kein wissenschaftlicher Nachweis vor.
- Siehe auch: Forschung zu den ältesten Menschen (Langlebigkeit, Hundertjährige und Hundertzehnjährige – engl. supercentenarians; Daten zur maximalen Lebensspanne)
Weiterführende Literatur
Fachzeitschriften zum Thema Altern
- Experimental Gerontology. Elsevier, seit 1964
- Mechanisms of Ageing and Development. Elsevier, seit 1972
- Ageing International. Springer, seit 1974
- Neurobiology of Aging. Elsevier, seit 1980
- Archives of Gerontology and Geriatrics. Elsevier, seit 1982
- Journal of Cross-Cultural Gerontology. Springer, seit 1986
- Journal of Aging Studies. Elsevier, seit 1987
- Gerontology. S. Karger, seit 1998
- Zeitschrift für Gerontologie und Geriatrie. Springer, seit 1998
- Journal of Aging and Identity. Springer, 1998–2002
- Biogerontology. Springer, seit 2000
- Ageing Research Reviews. Elsevier, seit 2002
- Immunity & Ageing. Journal im Open Access, Beiträge unter CC-by-sa, seit 2004
- European Journal of Ageing. Springer, seit 2004
- GeroScience Verlag Springer, seit 2005 (Fortsetzung des Journal of the American Aging Association)
- European Review of Aging and Physical Activity. Springer, seit 2006
- International Journal of Gerontology. Elsevier, seit 2007
- Journal of Population Ageing. Springer, seit 2008
- Journal of Nutrition, Health & Aging. Springer, seit 2008
- Aging. Journal im Open Access, Beiträge unter CC-by-sa, seit 2009
Fachbücher
- R. Arking: The biology of ageing. 3. Auflage, Oxford University Press, 2006, ISBN 0-19-516739-2
- P. B. Baltes, J. Mittelstraß, U. M. Staudinger (Hrsg.): Alter Und Altern: Ein interdisziplinarer Studientext zur Gerontologie. Walter de Gruyter, 1994, ISBN 3-11-014408-5 eingeschränkte Vorschau in der Google-Buchsuche
- A. Baudisch: Inevitable aging?: contributions to evolutionary-demographic theory. Springer, 2008, ISBN 978-3-540-76655-1, eingeschränkte Vorschau in der Google-Buchsuche
- V. L. Bengtson u. a.: Handbook of theories of aging. Springer, 2009, ISBN 978-0-8261-6251-9 eingeschränkte Vorschau in der Google-Buchsuche (englisch)
- Commission on Life Sciences (Hrsg.): Aging in today’s Environment. National Academy Press, 1987 (englisch)
- D. Ganten und K. Ruckpaul (Hrsg.): Molekularmedizinische Grundlagen von altersspezifischen Erkrankungen. Springer, 2004, ISBN 3-540-00858-6 eingeschränkte Vorschau in der Google-Buchsuche
- P. Gruss (Hrsg.): Die Zukunft des Alterns: die Antwort der Wissenschaft. C. H. Beck, 2007, ISBN 978-3-406-55746-0, eingeschränkte Vorschau in der Google-Buchsuche (ein Bericht der Max-Planck-Gesellschaft)
- M. S. Kanungo: Biochemistry of Ageing, Academic Press, 1980, ISBN 0-12-396450-4 (englisch)
- J. Kocka und U. Staudinger (Hrsg.): Gewonnene Jahre – Empfehlungen der Akademiengruppe Altern in Deutschland. (PDF; 5,6 MB), Nova Acta Leopoldinam, Band 107, 2009, ISBN 978-3-8047-2550-8.
- A. Kruse: Enzyklopädie der Gerontologie. Huber, 2004, ISBN 3-456-83108-0
- A. Kruse: Alter: Was stimmt? Herder, 2007, ISBN 978-3-451-05750-2
- U. Lehr: Psychologie des Alterns. Ausgabe 11, Quelle & Meyer, 2006, ISBN 3-494-01432-9
- E. J. Masoro und S. N. Austad (Hrsg.): Handbook of the biology of aging. 6. Ausgabe, Academic Press, 2006, ISBN 0-12-088387-2 eingeschränkte Vorschau in der Google-Buchsuche (englisch)
- A. Motel-Klingebiel, S. Wurm und C. Tesch-Römer (Hrsg.): Altern im Wandel. Befunde des Deutschen Alterssurveys (DEAS). Kohlhammer, 2010, ISBN 978-3-17-021595-5.
- H. Reimann und H. Reimann: Das Alter: Einführung in die Gerontologie. Lucius & Lucius, 1994, ISBN 3-432-92893-9 eingeschränkte Vorschau in der Google-Buchsuche
- M. R. Rose: Evolutionary Biology of Aging. Oxford University Press, 1994, ISBN 0-19-509530-8
- R. Schulz: The Encyclopedia of Aging. Band 1+2, Ausgabe 4, Springer, 2006, ISBN 0-8261-4843-3, eingeschränkte Vorschau in der Google-Buchsuche (englisch)
- David A. Sinclair, Matthew D. LaPlante: Das Ende des Alterns. Die revolutionäre Medizin von morgen. DuMont, Köln 2019, ISBN 978-3-8321-8104-8 (englisch: Lifespan. Übersetzt von Sebastian Vogel).
- A. Weismann: Aufsätze über Vererbung und verwandte biologische Fragen. G. Fischer, Jena 1892
- Norman S. Wolf (Hrsg.): Comparative Biology of Aging. Springer, 2010, ISBN 978-90-481-3464-9.
Reviewartikel und Buchbeiträge
- P. J. Hornsby: Senescence and life span. In: Pflügers Archiv – European Journal of Physiology. Band 459, Nummer 2, Januar 2010, S. 291–299, doi:10.1007/s00424-009-0723-6. PMID 19763609
- M. Muers: Ageing: Predicting long life. In: Nature Reviews Genetics. 11, 2010, S. 530. doi:10.1038/nrg2833 PMID 20628349
- L. Fontana u. a.: Extending healthy life span--from yeast to humans. In: Science. 328, 2010, S. 321–326. PMID 20395504
- Hans-Jörg Ehni: Kann man sich Elina Makropoulos als glücklichen Menschen vorstellen? Ein Beitrag zur ethischen Debatte über den individuellen Wert eines längeren Lebens. In: L. Honnefelder u. a. (Hrsg.): Jahrbuch für Wissenschaft und Ethik. Walter de Gruyter, 2009, ISBN 978-3-11-020884-9, S. 47–70. eingeschränkte Vorschau in der Google-Buchsuche
- G. Campisi u. a.: Pathophysiology of age-related diseases. In: Immunity & Ageing. 6, 2009, 12 doi:10.1186/1742-4933-6-12 (Open Access)
- O. Fernandez-Capetillo: Intrauterine programming of ageing free. In: EMBO reports. 11, 2009, S. 32–36. doi:10.1038/embor.2009.262
- E. Derhovanessian u. a.: Immunity, ageing and cancer. In: Immunity & Ageing. 5, 2008, 11 doi:10.1186/1742-4933-5-11 (Open Access)
- Alexander Bürkle u. a.: Pathophysiology of ageing, longevity and age related diseases. In: Immunity & Ageing. 4, 2007, 4 doi:10.1186/1742-4933-4-4 (Open Access)
- Gundolf Keil: Altern und Alter in der Antike. In: Aktuelle Gerontologie 13, 1983, S. 47–52.
Populärwissenschaftlich
- Uta Henschel: Das Geheimnis der Methusalem-Tiere. In: Spiegel Online, 21. Mai 2005.
- Rafaela von Bredow: Alternsforschung: Die Abschaffung des Sterbens. In: Der Spiegel. Nr. 30, 2005 (online).
- Markus Becker: Forscher finden Pfad zum Jungbrunnen. In: Spiegel Online, 14. April 2004.
- Luise Wagner-Roos u. a.: Ewig jung. In: Focus. 5, 1996, vom 29. Januar 1996.
Literarisch
- Andrea Wüstner (Hrsg.) So jung wie die Hoffnung – Gedichte und Geschichten vom Älterwerden, Philipp Reclam jun., Stuttgart 2012, ISBN 978-3-15-010758-4.
Weblinks
- N. Podbregar: Was lässt uns altern? scinexx.de, vom 16. April 2010
- M. Platzer: Warum altern wir? Möglichkeiten & Grenzen der Alternsforschung. (PDF; 3,8 MB) Leibniz-Institut für Altersforschung
- Leibniz-Forschungsverbund Healthy Ageing
- Leibniz-Institut für Altersforschung – Fritz-Lipmann-Institut (FLI) e.V.
- Deutsches Zentrum für Altersfragen
- Deutscher Alterssurvey
- Deutsche Gesellschaft für Gerontologie und Geriatrie
- American Federation for Aging Research (englisch)












