Bromoform
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
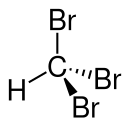
| ||||||||||||||||||||||
| Keilstrichformel zur Verdeutlichung der Geometrie | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Bromoform | |||||||||||||||||||||
| Andere Namen |
|
|||||||||||||||||||||
| Summenformel | CHBr3 | |||||||||||||||||||||
| Kurzbeschreibung |
farblose, chloroformähnlich riechende Flüssigkeit |
|||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 252,75 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig |
|||||||||||||||||||||
| Dichte |
2,89 g·cm−3 (20 °C) |
|||||||||||||||||||||
| Schmelzpunkt |
9,2 °C |
|||||||||||||||||||||
| Siedepunkt |
149,5 °C |
|||||||||||||||||||||
| Löslichkeit |
|
|||||||||||||||||||||
| Brechungsindex |
1,5948 (25 °C) |
|||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK |
Schweiz: 0,5 ml·m−3 bzw. 5 mg·m−3 |
|||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||||||||
| ΔHf0 |
−22,3 kJ/mol |
|||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Bromoform (CHBr3) ist ein halogenierter Kohlenwasserstoff. Die Verbindung ist der dreifachsubstituierte Vertreter der Brommethane: Brommethan, Dibrommethan, Tribrommethan und Tetrabrommethan.
Mit seiner Struktur (CHX3) ist es homolog zu Fluoroform, Chloroform und Iodoform und analog benannt.
Inhaltsverzeichnis
Vorkommen und Bildung
Bromoform entsteht im Meer aus dessen natürlichem Bromidgehalt durch Algen und andere Meeresorganismen. Es ist damit die stärkste Quelle organischen Broms in der Erdatmosphäre.
Es entsteht ebenfalls bei der Aufbereitung von Wasser für Kühl-, Bade- und Trinkzwecke und ist in allen chlorierten und ozonisierten Wässern enthalten. Küstenkraftwerke, die chloriertes Meerwasser zu Kühlzwecken verwenden, sind dessen stärkste von Menschen erzeugte Quelle.
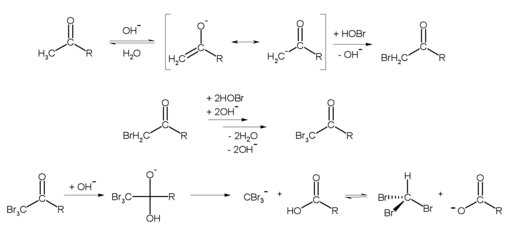
Im Labor kann Bromoform durch die Haloform-Reaktion beispielsweise aus Aceton (R = CH3) und Hypobromit hergestellt werden:
Eigenschaften
Bromoform reagiert mit vielen organischen Verbindungen, wobei giftige Bromverbindungen entstehen können. Mit Alkalimetallen reagiert es explosionsartig. Die Dämpfe sind schwerer als Luft. Beim Erhitzen über den Siedepunkt findet Selbstzersetzung statt.
Atmosphärisches Verhalten
Aus der in der Atmosphäre kurzlebigen Verbindung werden Bromradikale freigesetzt, die für fotochemische Vorgänge in der Troposphäre und Stratosphäre verantwortlich sind. Sie spielen unter anderem eine Rolle bei der Entstehung des Ozonlochs.
Verwendung
Bromoform wurde früher gegen Keuchhusten, als Beruhigungsmittel und zur Trennung von Mineralgemischen verwendet. Als natürlicher Bestandteil von Rotalgen der Art (Asparagopsis taxiformis) führt Bromoform zu einer beträchtlichen Minderung von Methanemissionen bei Wiederkäuern, wenn diese Rotalgen oder Rotalgenextrakte als Futterzusatz erhalten.