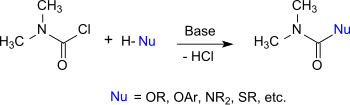Dimethylcarbamoylchlorid
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Dimethylcarbamoylchlorid | ||||||||||||||||||
| Andere Namen |
|
||||||||||||||||||
| Summenformel | C3H6ClNO | ||||||||||||||||||
| Kurzbeschreibung |
klare farblose bis schwach gelbliche Flüssigkeit |
||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 107,54 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig |
||||||||||||||||||
| Dichte |
|
||||||||||||||||||
| Schmelzpunkt |
−33 °C |
||||||||||||||||||
| Siedepunkt |
|
||||||||||||||||||
| Dampfdruck |
|
||||||||||||||||||
| Löslichkeit |
Zersetzung in Wasser. Löslich in inerten Lösungsmitteln, wie Benzol,Xylol,Chloroform, Aceton, Ethylacetat, 1,4-Dioxan, Pyridin und Kohlenstoffdisulfid |
||||||||||||||||||
| Brechungsindex |
1,4540 (20 °C, 589 nm) |
||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Dimethylcarbamoylchlorid (DMCC) ist ein Reagens zur Übertragung der Dimethylcarbonyl-Funktion auf alkoholische oder phenolische Hydroxygruppen unter Bildung von Dimethyl-carbamaten, die pharmakologische und pestizide Aktivitäten besitzen. Wegen seiner hohen Giftigkeit und seiner im Tierversuch sowie vermutlich auch beim Menschen krebserregenden Eigenschaften darf Dimethylcarbamoylchlorid nur unter strikten Sicherheitsvorkehrungen verwendet werden.
Vorkommen und Darstellung
Bereits 1879 wurde die Darstellung von Dimethylcarbamoylchlorid (hier als „Dimethylharnstoffchlorid“ bezeichnet) aus Phosgen und Dimethylamin (DMA) berichtet.
Bei der Reaktion von Phosgen mit gasförmigem Dimethylamin in einem Durchflussreaktor entsteht bei 275 °C Dimethylcarbamoyl-chlorid in hoher Ausbeute (90 %). Zur Unterdrückung der Bildung von Harnstoffen wird mit einem Phosgenüberschuss (COCl2 : DMA = 3 : 1) gearbeitet.
Die Reaktion kann auch im Labormaßstab mit Diphosgen bzw. Triphosgen und wässriger Dimethylaminlösung im Zweiphasen-system Benzol + Xylol/Wasser in einem Rührreaktor mit Natriumhydroxid als Säurefänger durchgeführt werden, allerdings wegen der Hydrolysempfindlichkeit des DMCC mit erheblich niedrigen Ausbeuten (56 %).
Bei der Umsetzung von Phosgen mit Trimethylamin entsteht ebenfalls Dimethylcarbamoylchlorid und Methylchlorid
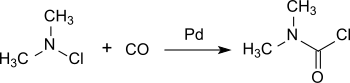
Ein neueres Verfahren geht aus von Dimethylaminchlorid aus, das an einem Palladium-Katalysator unter Druck mit Kohlenmonoxid bei Raumtemperatur praktisch quantitativ zu DMCC umgesetzt wird.
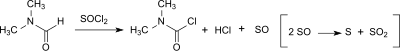
Auch bei der Vilsmeier-Haack-Reaktion kann in geringen Mengen (0–20 ppm) Dicarbamoylchlorid aus Dimethylformamid (DMF) entstehen, ebenso wie beim Einsatz von DMF als Katalysator bei der Umsetzung von Carbonsäuren mit Thionylchlorid zu den entsprechenden Carbonsäurechloriden.
Die Neigung zur Bildung von DMCC hängt vom Chlorierungs-reagens ab (Thionylchlorid > Oxalylchlorid > Phosphoroxychlorid) und ist bei Anwesenheit einer Base höher. Allerdings hydrolysiert DMCC so schnell – mit einer Halbwertszeit von ca. 6 Minuten bei 0 °C – zu Dimethylamin, Salzsäure und Kohlendioxid, dass nach wässriger Aufarbeitung weniger als 3 ppm DMCC im Vilsmeier-Produkt gefunden wird.
Eigenschaften
Dimethylcarbamoylchlorid ist eine klare, farblose, korrosive und brennbare Flüssigkeit mit stechendem Geruch und tränenreizender Wirkung, die sich in Wasser schnell zersetzt. Wegen seiner in der Handhabung unangenehmen sowie giftigen, mutagenen und im Tierversuch erwiesen cancerogenen Eigenschaften sollte DMCC mit äußerster Vorsicht gehandhabt werden.
Dimethylcarbamoylchlorid verhält sich wie ein Säurechlorid, dessen Chloratom gegen andere Nukleophile ausgetauscht werden kann. So reagiert es mit Alkoholen, Phenolen und Oximen zu den entsprechenden N,N-Dimethylcarbamaten, mit Thiolen zu Thiolourethanen, mit Aminen und Hydroxylamin zu substituierten Harnstoffen und mit Imidazolen und Triazolen zu Carbamoylazolen.
DMCC ist weniger reaktiv und gegenüber Substraten mit mehreren nukleophilen Zentren weniger selektiv als herkömmliche Säurechloride.
Ungesättigte konjugierte Aldehyde, wie Crotonaldehyd reagieren mit Dimethylcarbamoylchlorid unter Bildung von Dienylcarbamaten,
die als Diene in Diels-Alder-Reaktionen eingesetzt werden können.
Bei der Reaktion von Dimethylcarbamoylchlorid mit Alkalicarboxylaten entstehen die entsprechenden Dimethylamide. Mit wasserfreiem Natriumcarbonat bzw. mit überschüssigem Dimethylamin reagiert DMCC zu Tetramethylharnstoff.
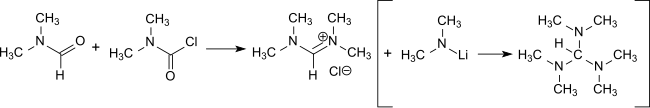
Bei der Reaktion von DMCC mit DMF entsteht Tetramethylformamidiniumchlorid, ein wesentliches Zwischenprodukt in der Darstellung von Tris(dimethylamino)methan, einem Reagens zur Einführung von Enaminfunktionen in Verbindung mit aktivierten Methylengruppen und zur Darstellung von Amidinen.
Dimethylcarbamoylchlorid ist ein Edukt für die Insektizid-Stoffklasse der Dimethylcarbamate, die als Hemmstoffe der Acetylcholinesterase wirken, darunter Dimetilan,
und die verwandten Verbindungen Isolan, Pirimicarb und Triazamat.
Pharmazeutische Anwendungen als Acetylcholinesterasehemmer finden die quartären Ammoniumverbindungen Neostigmin, das aus 3-Dimethylaminophenol und Dimethylcarbamoylchlorid und anschließender Quaternisierung mit Methylbromid bzw. Dimethylsulfat erhalten wird
und Pyridostigmin, das aus 3-Hydroxypyridin und DMCC und anschließender Umsetzung mit Methylbromid zugänglich ist.
Auch bei der Synthese des Benzodiazepins Camazepam findet Dimethylcarbamoylchlorid Verwendung.