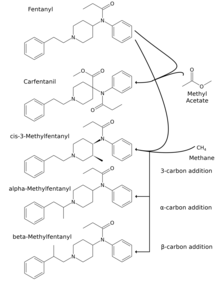
Fentanyl
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Fentanyl | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C22H28N2O | |||||||||||||||||||||
| Kurzbeschreibung |
Weißes bis fast weißes, polymorphes Pulver |
|||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 336,47 g·mol−1 | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Fentanyl (auch Fentanil) ist ein synthetisches Opioid, das als Schmerzmittel (Analgetikum) in der Anästhesie (bei Narkosen) sowie zur Therapie akuter und chronischer Schmerzen, die nur mit Opioidanalgetika ausreichend behandelt werden können, eingesetzt wird. Es wird als Injektion, transdermales Pflaster, oral-transmukosale Zubereitung und als Nasenspray verwendet und gilt als unentbehrliches Arzneimittel der WHO.
Fentanyl wirkt als Agonist am μ-Opioidrezeptor. Fentanyl ist als Arznei- und Rauschmittel unter anderem dem deutschen und Schweizer Betäubungsmittelgesetz sowie dem österreichischen Suchtmittelgesetz unterstellt. In den Vereinigten Staaten ist Fentanyl aufgrund illegaler Nutzung das Arznei- oder Rauschmittel, das 2021 zu den meisten Überdosis-Toten geführt hat (Opioidkrise in den Vereinigten Staaten).
Inhaltsverzeichnis
Geschichte
Fentanyl wurde 1959/1960 von Paul Janssen als erstes Anilinopiperidin (4-Anilinopiperidin-4-carboxamid) entwickelt. Es gehört zur größeren Gruppe der Pethidin-abgeleiteten Opioide und wurde bei der Untersuchung der Wirkungen von Pethidin-Analoga entdeckt. Fentanyl wird als Citrat verwendet und wurde als Medikament 1963 in einigen westeuropäischen Ländern eingeführt. In den Vereinigten Staaten wurde es 1968 unter dem Handelsnamen Sublimaze zugelassen. Seitdem wurden aus Fentanyl durch Modifikationen der Molekülstruktur eine Reihe besser steuerbarer Analoga und Derivate entwickelt. Es werden Fentanyl-Derivate untersucht, die zur Verstärkung der Wirkung eine zweite Funktion zur Bindung an andere Schmerz-assoziierte Rezeptoren aufweisen.
Auch bei den Darreichungsformen gab es Entwicklungen. In den 1990er Jahren wurden Fentanylpflaster für die Zufuhr des Wirkstoffs durch die Haut entwickelt. Im Jahr 1998 wurden Fentanyllutschtabletten zugelassen, ab 2009 folgten wasserlösliche Fentanylschmelzfilme als Formulierungen für die Resorption über die Mundschleimhaut. Jüngere Formulierungen solcher Rapid-Onset Opioids (ROOs) ermöglichen die Applikation von Fentanyl über die Nase (Nasenspray). Der Großteil medizinisch verwendeten Fentanyls wird in Europa und den Vereinigten Staaten eingesetzt (insgesamt 75 % des Weltmarktes in 2020), darunter in den Vereinigten Staaten und Deutschland mit je etwa 18 % des Weltmarkts von 2018–2020. Die Herstellung von medizinisch verwendetem Fentanyl (Administrative Controlled Substances Code Number 9801) nahm von 2300 kg im Jahr 2016 auf 731 kg im Jahr 2021 ab.
Seit 1979 wird Fentanyl nichtmedizinisch (illegalerweise) verwendet, seit den 2000er Jahren zunehmend und insbesondere in Nordamerika, der EU und Großbritannien. In den letzten Jahren ist eine Reihe von Fentanyl-Derivaten für den Schwarzmarkt entwickelt worden. Der größte Markt für nichtmedizinisch verwendetes Fentanyl sind die Vereinigten Staaten. Der Großteil wurde ab 2013 in China hergestellt. Seit ab 2019 in China die Herstellung und Anwendung von Fentanyl kontrolliert wird, werden für nichtmedizinisch verwendetes Fentanyl zunehmend die Vorläuferstoffe für die Synthese von Fentanyl von China nach Mexiko geliefert, wo es für den nordamerikanischen Schwarzmarkt hergestellt wird.
Wirkung
Fentanyl wirkt stark schmerzlindernd (analgetisch) und sedierend, daneben auch atemdepressiv, antitussiv, pulsverlangsamend, blutdrucksenkend, verstopfend und teils euphorisierend. Der Konsum von Fentanyl aktiviert das Belohnungssystem und wirkt verstärkend, was hauptursächlich zum Missbrauch und zu den Toden durch Überdosierung beiträgt. Im Vergleich zu anderen Opioiden verursacht Fentanyl eine stärkere Muskelsteifheit.
Nebenwirkungen
Wie auch andere Opioide provoziert Fentanyl bei Überdosierung eine Störung des Zentralnervensystems mit Bewusstseinsstörungen, Somnolenz und Atemdepression. Das akute Bild weist im Wesentlichen ausgeprägte Sedierung, Miosis (Verengung der Pupille) und Atemdepression auf, wobei diese bis hin zum Atemstillstand besonders hervorzuheben ist. Fentanyl kann mit Naloxon antagonisiert werden.
Typische Nebenwirkungen umfassen Übelkeit, Erbrechen, Verstopfung, Jucken, Benommenheit, Verwirrtheit und Verletzungen durch mangelhafte Koordination. Schwerwiegende Nebenwirkungen umfassen Atemdepression, Sinnestäuschungen, Serotonin-Syndrom, niedriger Blutdruck und Opiatabhängigkeit. Im Vergleich zu Morphin erzeugt Fentanyl weniger Juckreiz und weniger Übelkeit. Die Muskelsteifheit in Brustkorb und Abdomen ist bei Fentanyl relativ stark ausgeprägt, was als wooden chest syndrome (‚hölzerner-Brustkorb-Syndrom‘) bezeichnet wird und vermutlich durch die Ausschüttung von Noradrenalin und Acetylcholin verursacht wird. Die Muskelsteifheit in den Muskeln der Atemwege kann eine Beatmung mit Beatmungsbeutel erschweren. Fentanyl erzeugt eine Bradykardie (Absenkung der Herzschlagfrequenz) durch eine Aktivierung des Parasympathikus in Folge einer Aktivierung des Vagusnervs. Daneben wirkt Fentanyl gefäßerweiternd, wodurch der Blutdruck sinkt. Die Gefäßweitung basiert zum überwiegenden Teil auf einer Wirkung im Gehirn, zum geringeren Teil durch direkte Einwirkung auf die Gefäße. Der Effekt der Gefäßweitung ist besonders ausgeprägt in Patienten mit Bluthochdruck oder Herz-Kreislauferkrankungen.
Seit 2005 berichtet die Food and Drug Administration (FDA) wiederholt über schwere Nebenwirkungen und Todesfälle in Zusammenhang mit fentanylhaltigen transdermalen therapeutischen Systemen, allein 2009 über 397 Todesfälle. So verwies auch die Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) 2012 darauf, dass die Indikation für transdermale, fentanylhaltige Pflaster streng zu stellen ist. So sollen sie nur bei chronischen Schmerzen verordnet werden, die nur mit Opioiden ausreichend gelindert werden und einer andauernden, kontinuierlichen Behandlung bedürfen. Während die FDA die Anwendung nur bei Patienten erlaubt, die über mindestens eine Woche 60 mg Morphin pro Tag oder mehr eingenommen haben (oder entsprechend ein anderes Opioid), rät die deutsche Fachinformation, bei Patienten ohne bisherige Opioideinnahme zunächst niedrig dosiert unretardierte Opioide zu geben, bis deren Dosis 12,5 μg/h Fentanyl (= 45 mg Morphin/Tag) entspricht, und erst dann auf ein Pflaster umzustellen.
Anwendungssicherheit
In einem Rote-Hand-Brief warnten Hersteller von Fentanylpflastern 2014 vor einer versehentlichen Übertragung des Fentanylpflasters auf die Haut einer anderen Person, z. B. während der gemeinsamen Nutzung eines Bettes oder beim engeren Körperkontakt. „Zum Schutz gegen versehentliches Verschlucken durch Kinder soll die Applikationsstelle sorgfältig ausgewählt und regelmäßig überwacht werden, ob sich das Pflaster noch dort befindet.“
Seit in den Vereinigten Staaten – allein bis 2012 über zehn – Kinder nach Kontakt mit Fentanylpflastern an einer Überdosis verstarben, warnt die FDA Eltern und Betreuer vor den tödlichen Gefahren der versehentlichen Exposition und betont die Notwendigkeit eines verantwortungsbewussten Umgangs mit den Pflastern. Sie veröffentlicht Tipps für Vorsichtsmaßnahmen und empfiehlt, mit dem Arzt das Vorhalten von Naloxon als Gegenmittel zu besprechen. Im März 2023 erfolgte in den USA die Zulassung eines rezeptfreien Naloxon-Nasensprays als Gegenmittel bei Opioid-Überdosierungen; zuvor schon hatte sich die FDA für eine Entlassung aus der Rezeptpflicht ausgesprochen.
Die Koordinierungsgruppe (CMDh) der nationalen Arzneimittelbehörden der EU beschloss im Dezember 2022, dass umfassende Maßnahmen getroffen werden sollen, um die Anwendungssicherheit von Fentanyl-Arzneimitteln zu erhöhen. Unter anderem müssen Hersteller die Verpackungen von Fentanylpflastern mit dem Warnhinweis „Versehentliche Anwendung oder Einnahme kann tödlich sein“ beschriften. Vorangegangen waren schwerwiegende Zwischenfälle durch versehentliche Exposition und Überdosierung. Patienten und Pflegekräfte sind anzuweisen, die Präparate vor dem Zugriff durch andere zu schützen.
Nachdem es in den USA Presseberichten zufolge bei Helfern vor Ort zu Vergiftungen durch unbeabsichtigten Kontakt mit Fentanyl gekommen sein soll, entkräftete eine Studie diese Möglichkeit der Intoxikation. Eine Aufnahme giftiger Mengen von Fentanylpulver über die Haut sei sehr unwahrscheinlich.
Wechselwirkungen
Die sedierende Wirkung von Fentanyl kann durch Beruhigungsmittel und Alkohol verstärkt werden. In Verbindung mit Monoaminooxidase-Hemmern können schwere Kreislauf- und Atemstörungen auftreten. Zwischen der Anwendung von MAO-Hemmern und Fentanyl sollen mindestens 14 Tage liegen. Durch die Plasmaeiweißbindung von 90 % kann es bei Verwendung in Schmerzpflastern zu Wechselwirkungen mit Präparaten wie Furosemid, Glibenclamid oder Omeprazol kommen. Der Abbauweg von Fentanyl führt über die Cytochromoxidase 450, so dass bei gleichzeitiger Einnahme von CYP 3A4-Induktoren (z. B. Johanniskraut-Präparate; beschleunigen den Abbau von Fentanyl) oder CYP 3A4-Inhibitoren (z. B. Ketoconazol, Erythromycin, Nefazodon, Diltiazem, Grapefruitsaft; verlangsamen den Abbau von Fentanyl und können zu erhöhten Plasmaspiegeln führen) Wechselwirkungen auftreten können.
Die Kombination von Fentanyl (und anderen Opioiden) mit Calciumantagonisten kann neben der Verminderung der Toleranzentwicklung auch zu einer Potenzierung der analgetischen Wirkung führen. 1985 wurde die potenzierende Wirkung von Nimodipin gegenüber der analgetischen Wirkung von Fentanyl beschrieben. So soll die kombinierte Gabe von 0,1 mg Fentanyl zusammen mit Nimodipin (1 µg/kg/min Infusion) die gleiche Wirksamkeit wie 2,45 mg Fentanyl besitzen, was einer Potenzierung um das 24,5-fache entspricht. Weitere Humanversuche zeigten, dass Nifedipin im Gegensatz zu Nimodipin keine Potenzierung der Fentanyl-Wirkung verursacht, allerdings war auch der Effekt von Nimodipin in dieser Studie deutlich schwächer (3-fache Potenzierung), als in der ersten Studie.
Durch die gleichzeitige Gabe von fentanylhaltigen Arzneimitteln mit serotonerg wirkenden Arzneimitteln (SSRI/SNRI) besteht ein Risiko für das Auftreten eines gefährlichen Serotoninsyndroms mit Symptomen wie Agitiertheit, Koma, Halluzinationen, Blutdruckkrisen, neuromuskulären Veränderungen und Herzrasen, wie im März 2013 gewarnt wurde.
Pharmakologie
| Affinitäten, Ki | Verhältnis | ||
|---|---|---|---|
| μ-Opioid- Rezeptor (MOR) |
δ-Opioid- Rezeptor (DOR) |
κ-Opioid- Rezeptor (KOR) |
MOR:DOR:KOR |
| 0,39 nM | >1.000 nM | 255 nM | 1:>2564:654 |
Fentanyl bindet an den Opioidrezeptor μ, der zu den G-Protein-gekoppelten Rezeptoren gehört. Die Struktur des Rezeptors mit gebundenem Fentanyl wurde elektronenmikroskopisch bestimmt (8EF5). Fentanyl ist etwa 70 bis 100 mal so potent wie Morphin (gemessen an der Masse ist nur ein Hundertstel der Menge an Fentanyl nötig, um die gleiche Wirkung zu erzielen) und besitzt eine höhere Wirksamkeit (das Wirkungsmaximum ist höher), während seine Wirkdauer in der Regel deutlich kürzer ist. Fentanyl wirkt bei einer intravenösen Gabe nach fünf bis 120 Sekunden analgetisch. Die maximale Wirkung tritt nach vier bis fünf Minuten ein. Die biologische Halbwertszeit liegt bei ein bis zwei Stunden. Die Berechnung von Dosierungsschemata für in der Anästhesie intravenös verabreichte Opioide erfordert jedoch eine komplexere Berücksichtigung ihres pharmakokinetischen Verhaltens, welches in der Literatur mit Multikompartimentmodellen beschrieben wird. Demnach fällt nach intravenöser Injektion die Fentanyl-Plasmakonzentration in drei Phasen unterschiedlich rasch ab, deren Halbwertszeiten rund 1 Minute, 19 Minuten und 7,9 Stunden betragen. Die zur Behandlung effektive Dosis (ED50) liegt bei 2 bis 20 µg/kg Körpergewicht bei laufender Überwachung der Atmung. Nach Bindung von Fentanyl an den Opioidrezeptor μ werden nicht nur G-Proteine vom Typ GI/0 aktiviert, sondern auch β-Arrestin. Die Aktivierung der GI/0 führt zur Hemmung der Adenylylcyclase. Dadurch wird weniger cAMP gebildet und dessen Konzentration sinkt, wodurch der Ca2+-Einstrom in die Nervenzelle sinkt und die Schmerzwahrnehmung abnimmt. Die Aktivierung von β-Arrestin ist vermutlich für die Atemdepression durch Opioide verantwortlich.
Daneben bindet Fentanyl aktivierend an Serotonin-Rezeptoren (Ki für die Bindung an 5HT1A 2,1 μM und an 5HT2A 1,3 μM). Fentanyl ist nur ein schwacher Inhibitor des Serotonintransporters (SERT) mit einer IC50 von 154 μM. Möglicherweise trägt die Aktivierung der Serotoninrezeptoren zur Letalität einer Überdosis bei.
Die schmerzstillende Wirkdauer von Fentanyl ist abhängig von der angewendeten Arzneiform: 48 bis 72 Stunden bei einem transdermalen Pflaster, bei transmukosaler Applikation 0,5 bis 2 Stunden, bei Buccaltabletten und Sublingualtabletten 4 bis 6 Stunden. Die analgetische Wirkdauer bei intravenöser Gabe von 0,6 bis 2,5 µg/kg beim spontan atmenden Patienten beträgt 20 bis 30 Minuten. Im Vergleich zu anderen Opioiden hat Fentanyl einen schnellen Wirkungseintritt und ist relativ kurz wirkend. Es hat nach der Resorption aus hinuntergeschluckten oralen Formen aufgrund des hohen First-Pass-Effektes eine Bioverfügbarkeit von circa 30 %. Der First-Pass-Effekt kann durch Gabe anderer nicht-intravenöser Formulierungen umgangen werden kann; so beträgt die Bioverfügbarkeit aus oral-transmukosalen oder transdermalen Darreichungsformen 50–90 %.
Fentanyl ist – wie auch sein Analogon Sufentanil – sehr lipophil, d. h. mit einem Octanol-Wasser-Verteilungskoeffizienten von über 700 gut fettlöslich und verteilt sich schnell in die Muskulatur und in fetthaltiges Gewebe. Dadurch kommt es zu einer Depotwirkung, die in einem Narkoseüberhang resultieren kann. Allgemein ist die Wirkung deutlich abhängig von der Dosis sowie Art und Dauer der Zufuhr (i.v.-Bolus oder kontinuierliche Zuführung etwa per Infusion). In der Anästhesiologie wurde der Begriff der kontextsensitiven Halbwertszeit (CSHT) eingeführt, die angibt, nach welcher Zeit ab dem Stop einer kontinuierlichen Infusion der Plasmaspiegel auf die Hälfte abgesunken ist. Für Fentanyl nimmt die CSHT mit fortwährender Infusionsdauer stetig zu und variiert mit der Größe des Eingriffs. Bei chirurgischen Patienten wurde die Halbwertszeit mit 3 bis 12 Stunden bestimmt. Bei transdermaler Zufuhr führt auch noch nach Entfernen des Pflasters die kontinuierliche Abgabe von Fentanyl aus dem Hautdepot in den systemischen Kreislauf zu einer ungefähr 2- bis 3-mal längeren Halbwertzeit als nach intravenöser Gabe. Fentanyl wird hauptsächlich in der Leber verstoffwechselt und nur zu weniger als zehn Prozent unverändert über die Nieren ausgeschieden. In der Leber wird Fentanyl zum pharmakologisch inaktiven Norfentanyl N-demethyliert (genauer: die Phenethylgruppe wird entfernt) und/oder hydroxyliert. Chronische Leber- oder Nierenerkrankungen haben nur einen geringen Einfluss auf den Abbau bzw. die Ausscheidung.
Anwendung
Fentanyl wird unter anderem in der Anästhesie,Onkologie,Militärmedizin,Palliativmedizin und Geburtsheilkunde als Schmerzmittel eingesetzt.
In der Anästhesie wird es zur Narkose, zur Spinal- und zur Epiduralanästhesie verwendet. Fentanyl ist das meistverwendete Opioid-Anästhetikum für Analgesie während einer Operation, unter anderem weil es wenige kardiovaskuläre Effekte und wenig Histaminausschüttung hervorruft. Haupteinsatzgebiet der intravenösen Form ist die Gabe als Schmerzmittel bei Operationen in Verbindung mit einem Schlafmittel und wahlweise einem muskelentspannenden Mittel (Muskelrelaxans). Je nach Wahl des Schlafmittels spricht man von „balancierter Anästhesie“ oder „totaler intravenöser Anästhesie“ (TIVA). Wegen der Gefahr der Atemdepression ist eine ständige Überwachung und das Bereithalten einer Beatmungsmöglichkeit erforderlich. Aufgrund der Lipophilie wird Fentanyl teilweise schwer kontrollierbar im Fettgewebe eingelagert und wieder freigegeben. Deshalb werden heute anstelle von Fentanyl häufig die weniger lipophilen verwandten Stoffe Alfentanil und Remifentanil verwendet. Bei fentanylhaltigen Wirkstoffpflastern ist wegen der gleichmäßigen Wirkung und der im Vergleich zur Anästhesie meist deutlich geringeren Dosis nach einer Einstellungsphase keine ständige Überwachung der Vitalfunktionen nötig.
Gebräuchlich ist Fentanyl als Fentanyldihydrogencitrat. Es gibt vier Anwendungsformen:
- als Injektion (etwa in der Anästhesie oder Notfallmedizin);
- als transdermales therapeutisches System (d. h. als auf die Haut geklebtes Membranpflaster bzw. Matrixpflaster), das den Wirkstoff (mit wahlweise 12,5, 25, 37,5, 50, 75, 100 oder 150 Mikrogramm pro Stunde) zur Aufnahme über die Haut freisetzt; teilweise auch per Iontophorese
- als schnell freisetzende Formulierung für die Aufnahme über die Mundschleimhäute (oral-transmukosal), etwa als 200 bis 1600 µg Wirkstoff enthaltende Lutschtablette mit integriertem Applikator zur Anwendung an der Mundschleimhaut, als Buccaltablette mit 100 bis 800 µg Wirkstoff oder als Sublingualtablette mit 50 bis 800 µg Fentanyl;
- die nasale Applikation, als Fentanyl-Nasenspray.
Diese schnell freisetzenden Formulierungen sind indiziert für die Behandlung von Durchbruchschmerzen (sehr intensiver minutenlanger Schmerz, typisch bei fortgeschrittener Krebserkrankung) bei Erwachsenen, die bereits eine Opioid-Basistherapie gegen ihre Tumorschmerzen erhalten.
Ein transdermales Pflaster mit einer Freisetzungsrate von 12 Mikrogramm Fentanyl pro Stunde am Arm einer Person
Synthese
Janssen-Methode
Die ursprüngliche, 1964 von Dr. Paul Janssen patentierte Synthese beinhaltet die Synthese von Benzylfentanyl aus N-Benzyl-4-Piperidon. Das resultierende Benzylfentanyl wird als Ausgangsstoff für Norfentanyl verwendet. Norfentanyl bildet bei der Reaktion mit Phenethylchlorid das Ausgangsopioid.
Seigfried-Methode
Bei der Seigfried-Methode wird zunächst N-Phenethyl-4-piperidon (NPP) synthetisiert. Dieses NPP-Nebenprodukt wird reduktiv zu 4-ANPP aminiert. Fentanyl wird durch die Reaktion von 4-Anilino-N-Phenethylpiperidin (4-ANPP) mit einem Acylchlorid hergestellt. Die Seigfried-Methode wurde in den frühen 2000er Jahren zur Herstellung von Fentanyl in in- und ausländischen illegalen Labors verwendet.
Gupta-Methode
Die Gupta-Methode (oder „Ein-Topf“-Methode) geht von 4-Piperidon aus und überspringt die direkte Verwendung von 4-ANPP/NPP vollständig; stattdessen werden die Verbindungen nur als Verunreinigungen oder vorübergehende Zwischenprodukte gebildet. In einer Studie aus dem Jahr 2021 mit 318 beschlagnahmten Proben war die Gupta-Methode der vorherrschende Syntheseweg in Proben, die vom Fentanyl Profiling Program (FPP) analysiert wurden. Die durchschnittliche Reinheit dieser nach der Gupta-Methode synthetisierten Proben betrug 13,6 %, mit einer Gesamtspanne von 0,2 % bis 36,4 %.
Suh-Methode
Bei der Suh-Methode (eine Totalsynthese) wird auf die direkte Verwendung von Piperidin-Vorstufen verzichtet, um das Ringsystem in-situ zu erzeugen. Der Teil dieser Synthese, der zur In-situ-Bildung von NPP führt, ist im Folgenden dargestellt.
Analytik
Zur sicheren qualitativen und quantitativen Bestimmung von Fentanyl in Blut-/Blutplasmaproben und Urin wird nach angemessener Probenvorbereitung die Kopplung der Gaschromatographie oder HPLC mit der Massenspektrometrie eingesetzt. Zur Dopingkontrolle werden diese Methoden ebenfalls angewandt. Auch Immunassays und elektrochemische Analysen (Voltammetrie, Potentiometrie und Elektrochemilumineszenz) finden Verwendung. Typische Blut- oder Plasmakonzentrationen von Fentanyl im Menschen sind 0,3–3,0 μg/L bei medizinischem Gebrauch, 1–10 μg/L in Drogenkonsumenten und 3–300 μg/L bei akuter Überdosierung. Ein qualitativer Schnelltest kann mit dem Marquis-Reagenz durchgeführt werden.
Auch für forensische Untersuchungen kommen diese Verfahren zum Einsatz. In der Forensik gibt es nur eine geringe Korrelation zwischen der ante-mortem-Blutkonzentration von Fentanyl und der post-mortem-Blutkonzentration. Daneben erfolgt nach dem Tod eine Umverteilung des Fentanyls.
Rechtslage
Fentanyl ist als Arznei- und Rauschmittel unter anderem dem deutschen und Schweizer Betäubungsmittelgesetz sowie dem österreichischen Suchtmittelgesetz unterstellt. In den Niederlanden ist Fentanyl eine Substanz der Liste I des Opium-Gesetzes. In Estland wird Fentanyl seit den frühen 2000ern am längsten zum nichtmedizinischen Gebrauch verwendet, und zwar seit die Taliban den Anbau von Schlafmohn in Afghanistan verboten haben. In Großbritannien zählt Fentanyl als controlled Class A drug nach dem Misuse of Drugs Act 1971.
In den Vereinigten Staaten ist Fentanyl eine Schedule II controlled substance nach dem Controlled Substance Act. Vertreiber von Abstral sind verpflichtet, am FDA-genehmigten Risk-Evaluation-and-Mitigation-Strategy-Programm teilzunehmen (REMS). Zur Vermeidung von Missbrauch verlangen in den Vereinigten Staaten einige Versicherer Vorzertifizierung und/oder Mengenbegrenzung für Verschreibungen von Actiq. In Kanada ist Fentanyl eine Droge der Liste I nach dem Controlled Drugs and Substances Act. Laut einem Bericht in The Guardian von 2018 haben viele große Drogenhändler im Dark Web selbsttätig den Handel mit Fentanyl eingestellt.
Veterinärmedizin
Fentanyl wird zur Sedierung und Schmerztherapie in Kleintieren verwendet. Im Vergleich zu anderen Opioiden erzeugt es in Kleintieren weniger Erbrechen, eine tiefere Sedierung und weniger kardiovaskuläre Effekte. Wie andere Opioide wird Fentanyl in Hunden mit Dysphorie assoziiert.
Zur Behandlung chronischer Schmerzustände stehen aus der Humanmedizin transdermale Verabreichungssysteme zur Verfügung, die auch bei Kleintieren eingesetzt werden können (off label). Die 2012 in der EU und den USA neu im Markt eingeführte transdermale Lösung für die einmalige Anwendung gegen postoperative Schmerzen bei Hunden (Recuvyra) vermarktet der Hersteller nicht mehr.
Drogenmissbrauch

Spätestens seit 2006 nimmt der Missbrauch von Fentanyl in den Vereinigten Staaten zu. In einem Bericht sprach das CDC von 1000 Toten zwischen 2005 und 2007; die meisten Fälle wurden in Chicago, Philadelphia und Detroit registriert. Ab 2013 waren Fentanyl und seine Analoga vermehrt in den Vereinigten Staaten auf dem Schwarzmarkt erhältlich. Die daraus folgende Zunahme an Überdosis-Toten durch Fentanyl wird in den Vereinigten Staaten als dritte Welle der Drogentoten-Epidemie bezeichnet. Im Jahr 2014 waren es 4200 Tote. Vorläufige Daten zeigen, dass Fentanyl für einen großen Teil der geschätzt 59.000 bis 65.000 Drogentoten des Jahres 2016 in den Vereinigten Staaten ursächlich war. Im Bezirk Montgomery County wurde im Januar und Februar 2017 bei 99 von 100 Drogentoten Fentanyl oder ein Analogon nachgewiesen. Laut New York Times starben allein auf Long Island 2016 mindestens 220 Menschen durch den Missbrauch von Fentanyl. Von den über 90.000 Personen, die im Jahr 2020 in den Vereinigten Staaten an einer Überdosis starben, nahm jede zweite Fentanyl. Im Jahr 2021 starben in den USA 70.000 Menschen an Fentanyl. Es ist für Amerikaner in der Altersgruppe zwischen 18 und 45 Jahren die häufigste Todesursache. Die Drug Enforcement Administration (DEA) beschlagnahmte 2022 mehr als 4500 kg Fentanyl und über 50 Millionen Fentanyltabletten – mehr als doppelt soviel wie 2021 und genug, um die gesamte Bevölkerung der Vereinigten Staaten zu töten.
Ein Grund für die hohen Todesraten bei Fentanylanwendungen ist die geringe therapeutische Breite. Während eine therapeutische Dosis injizierten Fentanyls über 0,02 mg/kg Körpergewicht nur bei Anwendung der Herz-Lungen-Maschine möglich ist, liegt die letale injizierte Dosis für (Rhesus-)Affen bereits bei 0,03 mg/kg Körpergewicht. Fentanyl kann so schon in einer Menge ab 2 mg für einen erwachsenen, normalgewichtigen Menschen tödlich sein.
Eine besondere Gefahr geht auch von Fentanyl in Pulverform aus, so wie es als Ausgangsstoff zwecks Verarbeitung zu Fertigarzneimitteln erworben, aber auch auf dem Schwarzmarkt gehandelt wird, um dann z. B. als Injektion oder transnasal (über die Nasenöffnung) eingenommen zu werden. Es sind Zwischenfälle bekannt, in denen unbeabsichtigt das Pulver in der Luft verwirbelt wurde – beispielsweise beim Fallenlassen eines Behälters mit dem Stoff. So kann ungewollt Fentanyl-Aerosol in Nasen- und/oder Mundschleimhaut gelangen. Eine ungewollte Aufnahme über die Haut ist ebenso möglich, hängt jedoch sehr von der Kontaminationsdichte und den Expositionsbedingungen ab. Die chemisch-physikalische Form des Fentanyls (Base oder Salz, Pulver oder Lösung) und die Durchfeuchtung der Haut (etwa durch Schwitzen) beeinflussen die Penetrationsrate. Einer Studie zufolge sind pharmakologische bzw. toxische Wirkungen nur bei sehr hoher Exposition und verschwitzter Haut zu erwarten.
Fentanyl wird oft mit verschiedenen Zuckern (wie Lactose) oder Mannitol verschnitten. Fentanyl wird auch zum Strecken zahlreicher auf dem Schwarzmarkt erhältlicher Drogenzubereitungen eingesetzt; wie u. a. Heroin, Kokain, Amphetaminen oder ferner auch gepresster Tabletten (wie den berüchtigten „M30“-Fälschungen). Durch zu hohe Dosierung oder falsche Verteilung des Fentanyls kommt es so regelmäßig zu unwillkürlicher Überdosierung auf Seiten der Konsumenten, was nicht selten zu lebensgefährlichen Atemdepressionen und zum Tode führt, was die Gesamtzahl Drogentoter weltweit nach oben treibt. Fentanyl, das so verwendet oder direkt auf dem Schwarzmarkt verkauft wird, stammt teils aus legaler pharmazeutischer und teils aus illegaler Produktion. Die Verwendung von Fentanyl als Strecksubstanz ist besonders populär, da es – in bereits sehr geringer Dosierung eingesetzt – eine deutliche psychotrope Wirkung erreicht, wodurch die starke Streckung oft viel weniger augenscheinlich ist als die Beimengung von nicht psychotropen Substanzen, wie z. B. Lactose, Glukose, oder Ascorbinsäure. In einigen US-Bundesstaaten ist die Ausrüstung von Rettungs- und Polizeikräften mit lebensrettender Naloxonzubereitung (z. B. zur nasalen Applikation – wie Narcan) Standard.
Überdosierungen werden durch Injektion mit Naloxon behandelt. Zur langfristigen Behandlung der Fentanylabhängigkeit werden experimentelle Impfstoffe untersucht, die Antikörper gegen Fentanyl hervorrufen. Dadurch wird Fentanyl durch die Antikörper gebunden aus dem Blutkreislauf entfernt.
Kampfstoff
Neben ihrem Einsatz in der Medizin wurden Fentanyl-Derivate auch auf ihre Verwendbarkeit als chemische Kampfstoffe hin untersucht. Es wurden Vermutungen darüber angestellt, ob ein besonders potentes, in der Humanmedizin nicht zugelassenes Fentanyl-Derivat, das Carfentanyl, in Aerosol-Form bei der Geiselbefreiung im Moskauer Dubrowka-Theater im Oktober 2002 zum Einsatz kam und dabei für 127 Todesfälle durch Atemstillstand mitursächlich war.
Ein Derivat des Fentanyls wurde von einem israelischen Mossad-Kommando 1997 beim Mordanschlag auf Chalid Maschal in Jordanien eingesetzt. Es wirkte viel stärker als Fentanyl, wurde wie dieses durch die Haut aufgenommen (es wurde am Kopf aufgesprüht) und sollte in wenigen Tagen mit dem Anschein eines natürlichen Todes töten. Die Agenten wurden unmittelbar verhaftet und Israel gab auf diplomatischen Druck daraufhin den Jordaniern die Art des Wirkstoffs bekannt und das wirksame Gegenmittel (Naloxon) mit Anweisungen über die Behandlung.
Hinrichtungsmittel
Fentanyl wurde am 14. August 2018 erstmals als Bestandteil einer Wirkstoffmischung zur Hinrichtung des Doppelmörders Carey Dean Moore im Staatsgefängnis von Nebraska verwendet. Der Grund für den Einsatz bei letalen Injektionen in den USA ist die schwieriger werdende Beschaffung der zuvor verwendeten Giftstoffe (u. a. Thiopental) aufgrund eines Liefer- bzw. Produktionsstopps seitens der Hersteller. Auch der US-Bundesstaat Nevada plante den Einsatz von Fentanyl für Hinrichtungen. Nachdem der Hersteller gegen die seiner Meinung nach illegale Anwendung seines Präparats im Juli 2018 geklagt hatte, wurde die Hinrichtung von Scott Dozier ausgesetzt.
Handelsnamen
- Parenteral (intravenös, intramuskulär): Fentanyl B. Braun (D), Fentanyl Hameln (A), Fentanyl Mepha (CH), Sintenyl (CH), u. a.
- Transdermal (transdermales therapeutisches Pflaster): Durogesic (A), Durogesic SMAT (D), Durogesic Matrix (CH), Generika (Fentoron, Matrifen u. a.)
- Oral-transmukosal:
- Buccaltablette: Effentora (EU), Generika
- Buccalfilm: Breakyl (D)
- Lutsch-/Buccaltablette mit integriertem Applikator (Elan Pharma/Teva): Actiq (D, A, CH)
- Sublingualtablette: Abstral (D)
- Nasal-transmukosal (Nasenspray): PecFent (Archimedes Pharma), Instanyl (Takeda)
- Für Tiere (Hunde): Fentadon (D, A)
Literatur
- Eberhard Klaschik: Schmerztherapie und Symptomkontrolle in der Palliativmedizin. In: Stein Husebø, Eberhard Klaschik (Hrsg.): Palliativmedizin. 5. Auflage. Springer, Heidelberg 2009, ISBN 3-642-01548-4, S. 207–313, hier: S. 233 f., 251 f. und 466 f.
- Sam Quinones: The Least of Us: True Tales of America and Hope in the Time of Fentanyl and Meth. Bloomsbury, New York 2021, ISBN 978-1-63557-435-7.
- Michael A. Überall: Transmukosale Applikation von Fentanyl: sublingual, buccal, nasal — egal? In: MMW – Fortschritte der Medizin. Band 159, S6, 2017, S. 15–22, doi:10.1007/s15006-017-0081-1.
Weblinks
- Fentanyl. In: Erowid. (englisch)
- Fentanyl-Arzneimittel auf der Website der Europäischen Arzneimittelagentur (Europäischer Öffentlicher Beurteilungsbericht, EPAR)