Humane Papillomviren
| Humane Papillomviren | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
HPV im Elektronenmikroskop | ||||||||||||||
| Systematik | ||||||||||||||
| ||||||||||||||
| Taxonomische Merkmale | ||||||||||||||
| ||||||||||||||
| Wissenschaftlicher Name | ||||||||||||||
| Papillomaviridae | ||||||||||||||
| Links | ||||||||||||||
|
| Klassifikation nach ICD-10 | |
|---|---|
| B97.7 | Papillomaviren als Ursache von Krankheiten, die in anderen Kapiteln klassifiziert sind |
| B07 | Viruswarzen |
| Z22.8 | Keimträger sonstiger Infektionskrankheiten |
| ICD-10 online (WHO-Version 2019) | |
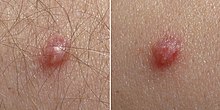
Humane Papillomviren (HPV, auch humane Papillomaviren, englisch human papillomaviruses) bilden eine Gruppe von DNA-Viren, die in mittlerweile mehr als 100 verschiedene Typen eingeteilt werden. Die HPV sind unbehüllte, doppelsträngige DNA-Viren (dsDNA) und gehören zur Familie der Papillomaviridae und den Gattungen Alphapapillomavirus, Betapapillomavirus und Gammapapillomavirus. Sie infizieren Epithelzellen der Haut und verschiedener Schleimhäute und können bei den infizierten Zellen ein unkontrolliertes tumorartiges Wachstum hervorrufen. Diese Tumoren sind meist gutartig und führen zur Warzenbildung an der betroffenen Haut- oder Schleimhautstelle (dem Ort der Infektion). Wenn die Infektion im Genital- oder Analbereich entsteht (i. d. R. durch Geschlechtsverkehr), kommt es zur Bildung von Genitalwarzen (z. B. Feigwarzen).
Einige HPV-Typen können jedoch auch bösartige Veränderungen hervorrufen, bei Frauen insbesondere das Zervixkarzinom (Gebärmutterhalskrebs). Vermutlich ist auch ein erheblicher Anteil der Scheiden-, Penis- und Analkarzinome Folge einer solchen HPV-Infektion. Auch an der Entstehung von Basalzellenkrebs („weißer Hautkrebs“) scheint eine HPV-Infektion begünstigend beteiligt zu sein. HPV kann durch Oralverkehr auch auf die Mundschleimhaut übertragen werden und dort Mundtumore auslösen.
Die Genprodukte dieser Viren, vor allem die des E6- und E7-Gens, verhindern den programmierten Zelltod (die Apoptose) und machen eine Reparatur des DNA-Doppelstranges unmöglich. Die durch Papillomviren verursachten Hautveränderungen sind häufig nicht mit bloßem Auge zu erkennen. Besondere Probleme stellen die durch die Viren verursachten Entartungen bei unkontrolliertem Wachstum dar, zum Beispiel wenn die Körperabwehr durch eine andere Erkrankung geschwächt ist.
Die erste Darstellung der Viren unter dem Elektronenmikroskop gelang 1949. Ab Mitte der 1970er Jahre wurden sie insbesondere in den Laboren von Harald zur Hausen und Gérard Orth vom Institut Pasteur untersucht. Zur Hausen erhielt 2008 für die Entdeckung des Zusammenhangs mit Gebärmutterhalskrebs den Nobelpreis für Physiologie oder Medizin.
Inhaltsverzeichnis
Virusgruppen
Zu unterscheiden ist die Klassifikation (anhand des Krankheitsbildes und -verlaufs) und die Taxonomie (anhand der genetischen Verwandtschaft).
Klassifikation
Bisher sind 124 HPV-Typen vollständig beschrieben. Etwa 30 davon infizieren fast ausschließlich Haut und Schleimhaut im Anogenitalbereich (Anus und Genitalien). Die genitalen HPV-Typen lassen sich generell in zwei Gruppen einteilen, die Niedrigrisiko- (low risk-) und die Hochrisiko- (high risk-)Typen. Die Einteilung geschieht aufgrund des Risikotyps: Einige wenige Erreger treten extrem gehäuft im Zusammenhang mit Karzinomen auf.
- Die Hochrisiko-Typen sind bei 99,7 % aller Fälle von Zervixkarzinomen (Krebstumoren des Gebärmutterhalses) identifiziert worden. Die Mehrheit der Zervixkarzinome (etwa 70 %) wiederum wird durch die Hochrisikotypen 16 und 18 hervorgerufen, gefolgt von den Genotypen 31 und 33.
- Die Niedrigrisiko-Typen sind fast nie direkt an der Entwicklung eines Zervixkarzinoms beteiligt. Bei multiplen Infektionen (Infektionen mit mehr als einem HPV-Genotyp) können sie aber auch in Zervixkarzinomen nachgewiesen werden, dann jedoch zusammen mit einem klinisch relevanten Hochrisikotyp.
Die Typen sind:
- „low-risk“-Viren
- Zu dieser Gruppe werden HPV 6 und 11 gezählt, weil sie als Hauptverursacher von Warzen in Genitalbereich (Condylomata acuminata, auch „Feigwarzen“ genannt) keine potenziell lebensgefährlichen Erreger sind. Weitere Low-risk-Typen sind 40, 42, 43, 44, 54, 61, 70, 72, 81 und CP6108.
- „high-risk“-Viren
- Zur zweiten Gruppe gehören v. a. HPV 16, 18, 31 und 33, aber auch 35, 39, 45, 51, 52, 56, 58, 59, 68, 73 und 82. Bei beinahe jedem Auftreten eines Zervixkarzinoms (Krebserkrankung des Epithelgewebes des Gebärmutterhalses) ist mindestens eine der High-risk-HPV-Gruppen in einem HPV-Screening nachweisbar. Auch einige Krebserkrankungen im Bereich des Afters sowie des Mundes gelten als HPV-assoziiert.
- möglicherweise „high-risk“-Viren
- Hierzu werden HPV 26, 53 und 66 gezählt.
- Viren ohne eindeutige Risikozuordnung (HPV genotypes of undetermined risk)
Die IARC hat 2005 die Genotypen 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 und 66 offiziell als krebserregend eingestuft. Die gefährlichen Virusuntergruppen sind nachweislich nicht nur an der Entstehung von Gebärmutterhalskrebs beteiligt, sondern man findet sie auch bei Krebserkrankungen des Penis, der Vulva (äußeres weibliche Genital), des Anus und des Rachenraumes.
Systematik
Die Entscheidung über verschiedene Taxa (taxonomische, d. h. Verwandtschaftsgruppen) wird von einem internationalen Gremium, dem International Committee on Taxonomy of Viruses (ICTV), beraten und getroffen. Die Taxonomie der Papillomaviridae ist mit Stand November 2018 folgende (bei Gattungen mit nur einer einzigen Species trägt diese die Nummer 1 und ist nicht eigens aufgeführt):
- Familie Papillomaviridae
- Unterfamilie Firstpapillomavirinae
- Genus Alphapapillomavirus (mit Species Alphapapillomavirus 1 bis 14)
- Genus Betapapillomavirus (mit Species Betapapillomavirus 1 bis 6)
- Genus Gammapapillomavirus (mit Species Gammapapillomavirus 1 bis 27)
- Genus Deltapapillomavirus (mit Species Deltapapillomavirus 1 bis 7)
- Genus Epsilonpapillomavirus (mit Species Epsilonpapillomavirus 1 und 2)
- Genus Zetapapillomavirus
- Genus Etapapillomavirus
- Genus Thetapapillomavirus
- Genus Iotapapillomavirus (mit Species Iotapapillomavirus 1 und 2)
- Genus Kappapapillomavirus (mit Species Kappapapillomavirus 1 und 2)
- Genus Lambdapapillomavirus (mit Species Lambdapapillomavirus 1 bis 5)
- Genus Mupapillomavirus (mit Species Mupapillomavirus 1 bis 3)
- Genus Nupapillomavirus
- Genus Xipapillomavirus (mit Species Xipapillomavirus 1 bis 5)
- Genus Omikronpapillomavirus
- Genus Chipapillomavirus (mit Species Chipapillomavirus 1 bis 3)
- Genus Pipapillomavirus (mit Species Pipapillomavirus 1 und 2)
- Genus Rhopapillomavirus (mit Species Rhopapillomavirus 1 und 2)
- Genus Sigmapapillomavirus
- Genus Taupapillomavirus (mit Species Taupapillomavirus 1 bis 3)
- Genus Upsilonpapillomavirus (mit Species Upsilonpapillomavirus 1 bis 3)
- Genus Phipapillomavirus
- Genus Psipapillomavirus (mit Species Psipapillomavirus 1 bis 3)
- Genus Omegapapillomavirus
- Genus Dyodeltapapillomavirus
- Genus Dyoepsilonpapillomavirus
- Genus Dyozetapapillomavirus
- Genus Dyoetapapillomavirus
- Genus Dyothetapapillomavirus
- Genus Dyoiotapapillomavirus (mit Species Dyoiotapapillomavirus 1 und 2)
- Genus Dyokappapapillomavirus (mit Species Dyokappapapillomavirus 1 bis 5)
- Genus Dyolambdapapillomavirus
- Genus Dyomupapillomavirus
- Genus Dyonupapillomavirus
- Genus Dyoxipapillomavirus (mit Species Dyoxipapillomavirus 1 und 2)
- Genus Dyoomikronpapillomavirus
- Genus Dyopipapillomavirus
- Genus Dyorhopapillomavirus
- Genus Dyosigmapapillomavirus
- Genus Dyotaupapillomavirus
- Genus Dyophipapillomavirus
- Genus Dyoupsilonpapillomavirus
- Genus Dyopsipapillomavirus
- Genus Dyoomegapapillomavirus
- Genus Treisdeltapapillomavirus
- Genus Treisepsilonpapillomavirus
- Genus Treiszetapapillomavirus
- Genus Treisetapapillomavirus
- Genus Treisthetapapillomavirus
- Genus Treisiotapapillomavirus
- Genus Treiskappapapillomavirus
- Unterfamilie Secondpapillomavirinae
- Genus Alefpapillomavirus
- Unterfamilie Firstpapillomavirinae
Übertragung
Die Infektion verläuft hauptsächlich über Hautkontakt, bei bestimmten Virentypen primär durch ungeschützten Sexualverkehr (Genital-, Anal- oder Oralverkehr). Die HPV-Infektion ist daher eine der häufigsten durch Geschlechtsverkehr übertragenen Infektionen, oft jedoch bleibt die Ansteckung unbemerkt. Kondome können das Ansteckungsrisiko halbieren. Seltener werden die Viren auch durch gemeinsam benutzte Handtücher, Trinkgläser oder Zahnbürsten übertragen. Im Rahmen einer bereits bestehenden Infektion kann eine Schamhaarentfernung mittels Rasur zu einer Infektion zuvor nicht betroffener Körperregionen führen.
Häufigkeit
Die Prävalenz von HPV ist afrikanischen Ländern am höchsten und in Europa und in Ländern am östlichen Mittelmeer am geringsten. Am häufigsten wurden die Hochrisikotypen 16 und 18 nachgewiesen. In Deutschland gibt es keine Meldepflicht für HPV-Infektionen, daher fehlen regelmäßig erhobene Daten zur Häufigkeit. Durch Studien kann man diese aber abschätzen, so liegt die Inzidenz bei vermutlich 170 Fälle pro 100.000 Personen-Jahren (definiert als Jahre, die die Personen während der Studie unter Beobachtung standen). Unter Frauen war diese mit 627 pro 100.000 Personenjahre in der Altersgruppe der 20- bis 24-Jährigen am höchsten und bei den Männern in der Altersgruppe der 25- bis 29-Jährigen mit 457 pro 100.000 Personenjahre.
Fast 80 % der Weltbevölkerung sind mit 50 Jahren an HPV infiziert. Bei Frauen unter 30 Jahren liegt die Infektionsrate bei bis zu 25 %. Bei über 30-Jährigen beträgt sie immer noch bis 8 %. Die HPV-Infektion heilt häufig innerhalb von Monaten bis hin zu anderthalb Jahren ab. Auch die generelle Immunitätslage der Frau spielt hierbei eine wichtige Rolle, daher haben Raucherinnen ein höheres Risiko.
Allgemeine Zahlen zu den Infektionsraten bei Männern gibt es nicht. Ursache für den Mangel an Zahlenmaterial ist das Nichtvorhandensein regulärer Vorsorgeuntersuchungen in diesem Bereich bei Männern. Bekannt ist, dass, wenn einer der Partner Läsionen aufweist, auch der andere mit hoher Wahrscheinlichkeit mit einem HPV infiziert ist. Bei bis zu 70 % der männlichen Partner einer Frau, die im HPV-Screening positiv getestet wurde, besteht ebenfalls eine Infektion, die jedoch oft nur kleinste Läsionen am Penis verursacht. Männer sind sich daher der Infektion mit dem HP-Virus oft gar nicht bewusst und bemerken diese nicht. Dennoch sind sie Überträger.
Eine von den US-Zentren zur Krankheitskontrolle und Vorbeugung (CDC) im März 2008 vorgestellte Studie unter 838 US-Amerikanerinnen zwischen 14 und 19 Jahren zeigte, dass 18,3 % von ihnen Papillomvirenträger waren.
Krankheitsfolgen
Nach einer Infektion können Papillomviren oft jahrelang inaktiv bleiben. Dies gilt sowohl für die Low-risk- als auch für die High-risk-Viren. Das heißt, dass sich auch Wochen bis Monate bzw. bis zu einem Jahr nach einem Sexualkontakt sowohl von heterosexuellen wie auch homosexuellen Paaren Genitalwarzen bilden können und damit die Suche nach dem infektiösen Sexualpartner sehr erschwert wird. Die häufigsten Krankheitsfolgen sind Warzen, besonders Feigwarzen (Condylomata acuminata), und bei Frauen das Zervixkarzinom (Krebserkrankung des Gebärmutterhalses).
HPV gehört zusammen mit dem Hepatitis-B-Virus (HBV), dem Hepatitis-C-Virus (HCV), dem Epstein-Barr-Virus (EBV), dem Humanen T-lymphotropen Virus 1 (HTLV-1) und dem Humanen Herpesvirus 8 (HHV-8, auch Kaposi-Sarkom-Herpesvirus, KSHV) zu einer Gruppe von humanen cancerogenen Viren (Onkoviren), die weltweit für 10 bis 15 Prozent aller Krebserkrankungen verantwortlich sind.
Tritt eine Infektion mit Papillomviren in Kombination mit einem bestimmten Gendefekt auf, kann sich eine als Epidermodysplasia verruciformis bezeichnete chronisch-generalisierte HPV-Infektion entwickeln.
Übersicht
| HPV-Typen | Krankheitsfolgen |
|---|---|
| HPV Typ 6 und 11 („low risk“) |
Condylomata acuminata („Feigwarzen“, Viruswarzen der Schleimhaut) und Buschke-Löwenstein-Tumor; sehr selten: Rezidivierende respiratorische Papillomatose (multiples, rezidivierendes Auftreten von meist gutartigen Plattenepithelpapillomen im Kehlkopf bis in Luftröhre (Trachea) und Lunge). |
| HPV Typ 6 und 11 („low risk“) sowie 16, 18 und 31 („high risk“) | Condylomata plana (werden je nach Lokalisation als CIN, VIN, VAIN, AIN und PIN bezeichnet) |
| HPV Typ 16, 18, 45 und 31 („high risk“) | Cervikale intraepitheliale Neoplasie (CIN): kann zu Gebärmutterhalskrebs (Zervixkarzinom) führen |
| HPV Typ 16 und 18 („high risk“) | Mundrachenkrebs (Oropharynxkarzinome) |
| HPV Typ 16 („high risk“) – (fast ausschließlich dieser Typ) | Bowenoide Papulose, meistens bei Männern als Penile intraepitheliale Neoplasie (PIN, Viruswarzen des Penis): kann zu Erythroplasie und Peniskarzinom führen |
| HPV Typ 16, 18, 45 und 31 („high risk“) | Vulväre intraepitheliale Neoplasie (VIN, Viruswarzen der Vulva) |
| HPV Typ 16, 18, 45 und 31 („high risk“) | Vaginale intraepitheliale Neoplasie (VAIN, Viruswarzen der Scheidenschleimhaut) |
| HPV Typ 16, 18, 45 und 31 („high risk“) | Anale intraepitheliale Neoplasie (AIN, Viruswarzen des Anus) |
| HPV Typ 13 und 32 („low risk“) | Morbus Heck (Viruswarzen der Mundschleimhaut) |
| HPV Typ 1, 2, 3 und 4 | Verruca vulgaris (gewöhnliche Hautwarze) |
| HPV Typ 1, 2, und 4 | Verruca plantaris (Plantarwarze) |
| HPV Typ 3 und 10 | Verruca plana juvenilis (juvenile flache Warzen) |
| HPV Typ 7 | „Fleischerwarze“ |
| HPV Typ 5 und 8 („intermediate risk“), sowie gelegentlich auch die anderen Typen der EV-Gruppe: 5, 8, 9, 12, 14, 15, 17, 19, 20, 21 und 47 | Epidermodysplasia verruciformis (EV) |
teilweise aus:
Männer und HPV
Mehrere Studien zeigen, dass etwa 64 bis 70 % der männlichen Beziehungspartner von Frauen, die unter einer HPV-Erkrankung des Gebärmutterhalses leiden, ihrerseits HPV-assoziierte Läsionen am Penis aufweisen. HPV kann dennoch auch in der Haut des Penis oft lange unerkannt präsent bleiben. In seltenen Fällen können bösartige Veränderungen, auch Karzinome, am Penis auftreten. Da das Peniskarzinom bei beschnittenen Männern extrem selten ist, werden zurückgehaltenes (retiniertes) Smegma und wiederholte Entzündungen der Penisvorhaut und der Eichel (chronische Eichelentzündung) bei unbeschnittenen Männern als entscheidende Faktoren der in zeitlicher wie auch ursächlicher Hinsicht schrittweisen Entstehung von Krebs (Karzinogenese) angesehen. Doch auch die Infektion mit dem humanen Papillomavirus allein, sowie dem Cytomegalievirus, gelten als Verursacher.
Mehrere Studien deuten auf HPV-Infektionen als Verursacher von Mundkrebs hin. Unter anderem diagnostizierte eine französische Studie bei einer hohen Anzahl an Mundkrebspatienten auch humane Papillomviren. Als Übertragungsweg gilt hier Oralverkehr. Einen sicheren Schutz gibt es nicht. Jedoch mindert die stringente Verwendung von Kondomen vermutlich das Übertragungsrisiko, siehe auch Safer Sex.
Bei Männern, die passiven Analverkehr mit anderen Männern betreiben, können Feigwarzen auch im Bereich des Anus auftreten. Die Symptome (Juckreiz, Brennen) einer analen Ansteckung mit HPV sind zunächst nur schwer zuzuordnen, zumal die Kondylome in jenem Bereich noch schwerer zu erkennen sind. Sind sie bereits mit bloßem Auge zu sehen oder können eindeutig ertastet werden, ist das Stadium meist bereits so weit fortgeschritten, dass eine operative Entfernung notwendig wird. Da diese mit einer schmerzvollen Heilungsphase verbunden ist und wegen der begrenzten Erfolgsaussichten manchmal mehrmals vorgenommen werden muss, sollten Männer mit Verdacht auf anale Feigwarzen sich frühzeitig für eine proktologische Untersuchung entscheiden.
Anale HPV-Infektionen treten v. a. bei homosexuellen Männern auf, die anorezeptiven Analverkehr praktizieren (also bei Männern, bei denen der Penis eingeführt wird). Bei homosexuellen Männern sind anale HPV-Infektionen häufiger als solche am Penis.
In Deutschland wird seit 2018 eine Impfung bei 9- bis 14-jährigen Jungen durch die Ständige Impfkommission (STIKO) empfohlen, die Kosten übernimmt bis zum 18. Geburtstag die Krankenkasse.
Diagnose
Die Tatsache, dass in 99,7 % der Zervixkarzinome Hochrisiko-Typen vorkommen (HPV 16: 50 %, HPV 18: 20 %), im Vergleich zu einer sonst geringen Rate, unterstreicht die Bedeutung der HPV-Infektion bei diesem Karzinom, das weltweit die zweithäufigste Krebserkrankung (und dritthäufigste Krebstodesursache) bei Frauen ist. Die DNA der HP-Viren kann mittels Polymerase-Kettenreaktion (PCR) nachgewiesen und weiter durch Sequenzierung oder Hybridisierung zwischen den verschiedenen Typen differenziert werden. Bei niedriger Viruskonzentration treten (wie bei jeder PCR) auch falsch negative Ergebnisse auf. Der Nachweis von HP-Viren ohne weitere Anzeichen einer Schleimhautveränderung am Gebärmutterhals lässt keine Aussage über ein mögliches Karzinomrisiko zu, da die Infektion in über 98 % der Fälle folgenlos ausheilt.
Therapie
- Artikel zur Symptombehandlung von HPV-Warzen: Condylomata acuminata#Behandlung
Eine spezifische Papillomvirustherapie gibt es gegenwärtig nicht. Bei vorliegenden Läsionen kommen im Wesentlichen chirurgische Eingriffe in Frage oder aber lokale Verätzungen. In der Regel wird mit der Entfernung der Läsion auch der Heilungsprozess eingeleitet, wenn auch Rückfälle (Rezidive) häufig sind. Systemische oder lokale Therapien, etwa mit Interferonen und anderen Zytokinen, haben bisher zu keinen durchschlagenden Erfolgen geführt.
Bei einer Studie in Mexiko wurde die Photodynamische Therapie getestet. Sämtliche Patienten ohne Läsionen waren am Ende der Behandlung frei von HPV, bei Patienten mit Läsionen waren es noch 57 %.
Präventive Impfung
Der HPV-Impfstoff Gardasil des US-Pharmakonzerns MSD Sharp & Dohme (in Österreich und Deutschland vertrieben durch das Joint Venture von MSD und Sanofi-Aventis Sanofi Pasteur MSD) zur vorbeugenden Impfung gegen die HPV-Typen 6,11 sowie die Hochrisikogenotypen 16 und 18 ist für Europa seit Ende September 2006 zugelassen, mittlerweile für beide Geschlechter ab 9 Jahren. Ein zweiter Impfstoff, Cervarix, von GlaxoSmithKline zur Impfung gegen die Hochrisikogenotypen 16 und 18 wurde im Herbst 2007 in Deutschland zugelassen. Im Jahr 2015 erfolgte schließlich die Zulassung des Impfstoffes Gardasil 9 zur Immunisierung gegen die HPV-Typen 6, 11, 16, 18, 31, 33, 45, 52, 58, dieser hat den Vorgänger Gardasil abgelöst. Diese Erreger gelten als Verursacher von über 90 % aller HPV-induzierten Malignome.
Die Impfung gegen HPV ist für beide Geschlechter (seit 2018 für Jungen) von 9 bis 14 Jahre insbesondere vor dem ersten sexuellen Kontakt durch die Ständige Impfkommission (STIKO) empfohlen. Versäumte Impfungen sollten so früh wie möglich bis zum Alter von 17 Jahren nachgeholt werden; die Kosten übernimmt bis zum 18. Geburtstag die Krankenkasse. Eine Kostenübernahme der Impfung bei bisher ungeimpften Frauen nach einer Konisation ist möglich. Im Alter von 9 bis 13 Jahren sind zudem nur noch 2 Impfdosen statt bisher 3 nötig. Ab einem höheren Alter oder einem geringeren Impfabstand als 6 Monaten zwischen 1. und 2. Impfung sind weiterhin 3 Impfdosen nötig. Beide Impfstoffe wirken vorbeugend (präventiv); eine bereits bestehende HPV-Infektion kann damit nicht behandelt bzw. beseitigt werden. Ebenso wenig können die Folgen einer solchen Infektion, wie beispielsweise Gebärmutterhalskrebs oder dessen Vorstufen mittels einer Impfung behandelt werden. Vorsorgeuntersuchungen zur frühzeitigen Erkennung des Gebärmutterhalskrebses (Pap-Test) sind trotz Impfung weiterhin notwendig.
Die damals noch offene Frage, ob eine HPV-Impfung die Inzidenz des Zervixkarzinoms und seiner Vorstufen tatsächlich verringern kann, ist inzwischen beantwortet: In Australien wurde nach der Einführung der Impfung bei jungen Mädchen ein Rückgang von Karzinom-Vorstufen um 75 % beobachtet. Eine weitere australische Studie bestätigt einen positiven Effekt auch für nicht geimpfte junge Männer, die nun auch seltener Genitalwarzen entwickeln. Nach einer am 28. Mai 2018 veröffentlichten kanadischen Studie mit 291.000 Mädchen im Alter von 12 bis 17 Jahren waren diese durch die Impfung keinem erhöhten Risiko von Autoimmunerkrankungen ausgesetzt. Eine Meta-Analyse der Cochrane Collaboration bei über 70.000 Probanden ist 2018 zu dem Schluss gekommen, dass die prophylaktische Impfung sicher und wirksam gegen Gebärmutterhalskrebs ist. Dieser Ansicht schlossen sich auch Wissenschaftler aus Schottland an. Die Auswertung von mehr als 100.000 Gesundheitsdaten hat ergeben, dass routinemäßige HPV-Impfungen bei Mädchen im Alter von 12-13 Jahren die Wahrscheinlichkeit für das Auftreten abnormaler Zellen und zervikaler intraepithelialer Neoplasien deutlich reduziert habe. Je früher eine HPV-Impfung stattgefunden hatte, desto wirksamer war die HPV-Impfung. In einer großen Beobachtungsstudie in England wurde dies bestätigt: Seit Einführung der Impfung im Jahr 2008 wurde ein deutlicher Rückgang sowohl beim Zervixkarzinom als auch bei der Vorstufe CIN3 verzeichnet. Falls die Impfung vor ersten sexuellen Kontakten erfolgt ist, war der Effekt am signifikantesten. Die Autoren schätzen zudem, dass in England die Impfung bis Ende Juni 2019 im Mittel 448 Zervixkarzinome und 17.235 CIN3-Läsionen verhindert hat.
Im Jahr 2020 wurde eine Untersuchung aus den schwedischen Gesundheits- und Bevölkerungsregistern mit einer Auswertung von Daten von 1,2 Mio. Mädchen und Frauen publiziert. Danach schützt die HPV-Impfung, wenn sie vor dem 17. Lebensjahr durchgeführt wird, vor über 80 % der bösartigen Erkrankungen am Gebärmutterhals.
Weitere Vorbeugungsmöglichkeiten
Eine effektive Maßnahme zur Vermeidung einer Ansteckung ist Safer Sex, wodurch sich das Risiko einer HPV-Infektion deutlich senken, aber nicht gänzlich verhindern lässt. Dies liegt insbesondere daran, dass es sich bei einer HPV-Infektion nicht um eine klassische Geschlechtskrankheit handelt, die über Körperflüssigkeiten übertragen wird, sondern um eine Kontaktinfektion, wodurch auch Körperstellen außerhalb des durch das Kondom geschützten Bereichs als Infektionsquelle dienen können.
Eine Studie fand ein geringeres Risiko für Gebärmutterhalskrebs bei den Partnerinnen von beschnittenen Männern der Hochrisikogruppe, welche ungeschützten Geschlechtsverkehr mit Prostituierten hatten: monogame Partnerinnen erkranken mit einer statistisch geringeren Wahrscheinlichkeit an einem Zervixkarzinom, wenn der Mann beschnitten ist und keinen ungeschützten Geschlechtsverkehr mit Prostituierten hat. In der vorliegenden Studie ist die gefundene Wahrscheinlichkeit moderat, jedoch nicht signifikant geringer (“moderate, but nonsignificant, decrease in the risk of cervical cancer”), wird also wissenschaftlich nicht hinreichend bestätigt.
Histone
Das „Manila clam xenomavirus“ (Papovaviricetes, Vorschlag) kann offenbar eukaryotische Histone für die eigene Verpackung, Steuerung oder zu seinem Schutz nutzen. 2022 wurde die Rolle von Histonen im Replikationszyklus einer Reihe von Viren umfassend untersucht.
Ursprung der HP-Viren
Im Gegensatz zum Humanen Immundefizienz-Virus (HIV) handelt es sich bei den HP-Viren um eine ausgesprochen alte Gruppe von Viren, die sich schon sehr lange an den Menschen angepasst hat. 2003 wurden bei der Untersuchung der Mumie von Maria von Aragon (1503–1568) anogenitale Warzen vom Typ Condylomata acuminata und Viren vom Hoch-Risiko-Typ HPV18 entdeckt. Eine Arbeitsgruppe der Universität Hongkong ist durch die Kombination von Bioinformatik und Analyse der Phylogenetik von HPV58 im Jahr 2017 zu dem Ergebnis gekommen, dass die Neandertaler oder Denisova-Menschen vor etwa 500.000 Jahren frühe HPV-Varianten wie 16a oder 58a aus Afrika nach Europa brachten. Woher diese wiederum die HP-Viren hatten, ist bisher ungeklärt.
Weblinks
- S3-Leitlinie Impfprävention HPV-assoziierter Neoplasien der Paul-Ehrlich-Gesellschaft für Chemotherapie (PEG). In: AWMF online (Stand 05/2020)
- Humane Papillomviren (HPV) – Informationen des Robert Koch-Instituts
- Mobilmachung gegen Krebs Bericht über die Forschung zur Entwicklung eines Impfstoffes gegen HPV-16
- Ulf Schleth: HPV und Impfung: Untenrum angesteckt. In: taz.de. 7. Oktober 2018, abgerufen am 23. November 2019.
- Wie viel Schutz bietet die HPV-Impfung vor Gebärmutterhalskrebs?
- Fragen zur Klinischen Prüfung und zur Zulassung des Paul-Ehrlich-Instituts zur Kritik an der Zulassung des HPV-Impfstoffes (Memento vom 3. Februar 2009 im Internet Archive)