
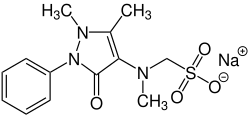
Metamizol-Natrium
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Metamizol-Natrium (INNv) | |||||||||||||||||||||
| Andere Namen |
|
|||||||||||||||||||||
| Summenformel | C13H16N3NaO4S | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse |
nichtsaures Nichtopioid-Analgetikum, Antipyretikum |
|||||||||||||||||||||
| Wirkmechanismus |
Unbekannt |
|||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 333,34 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest |
|||||||||||||||||||||
| Schmelzpunkt |
|
|||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten |
4351 mg Metamizol-Natrium-Monohydrat·kg−1 (LD50, Ratte, oral) |
|||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Metamizol-Natrium, kurz Metamizol genannt, ist ein schmerzstillender und fiebersenkender Wirkstoff mit krampflösender Komponente aus der Gruppe der nichtsauren Nichtopioid-Analgetika. Weitere geläufige Namen des Wirkstoffs sind Dipyron, Novaminsulfon und der Handelsname Novalgin. Chemisch handelt es sich um ein Pyrazolon-Derivat, der Name Metamizol leitet sich aus Methyl, Amino und Pyrazol ab. Im Organismus entsteht durch hydrolytische Spaltung der eigentliche Wirkstoff 4-Methylaminophenazon (4-Methylamino-1,5-dimethyl-2-phenyl-1,2-dihydro-3H-pyrazol-3-on).
Wegen der seltenen schweren Nebenwirkung Agranulozytose wurde Metamizol in vielen Industriestaaten vor allem des englischen Sprachraums, aber auch in weiteren Gebieten (z. B. in Skandinavien und Japan), nicht zugelassen oder eine bereits bestehende Zulassung wurde widerrufen. Im deutschsprachigen Raum dagegen ist die Anwendung des verschreibungspflichtigen Medikaments weit verbreitet, das zudem auch außerhalb der zugelassenen Indikationen zur Anwendung kommt. Das Arznei-Telegramm bezeichnete Metamizol im Dezember 2020 als Reserveanalgetikum.
Auch in der Tiermedizin wird der Wirkstoff als akut wirkendes Schmerzmittel eingesetzt, und er ist auch für lebensmittelliefernde Tiere zugelassen.
Pharmazeutisch verwendet wird das Natriumsalz von Metamizol bzw. seine kristallwasserhaltige Form Metamizol-Natrium-Monohydrat (Ph. Eur.). Metamizol-Natrium-Monohydrat ist ein weißes bis fast weißes kristallines Pulver, das sehr leicht löslich in Wasser, löslich in Ethanol 96 % und praktisch unlöslich in Dichlormethan ist. In der Säureform wird Metamizol nicht arzneilich eingesetzt.
Ferner sind ein Calciumsalz (Metamizol-Calcium) und ein Magnesiumsalz (Metamizol-Magnesium) beschrieben.
Inhaltsverzeichnis
- 1 Geschichte
- 2 Indikationen
- 3 Kontraindikationen
- 4 Pharmakokinetik
- 5 Wirkmechanismus
- 6 Nebenwirkungen
- 7 Wechselwirkungen
- 8 Gesundheitspolitische Bedeutung (Pharmakovigilanz)
- 9 Zulassungen im internationalen Vergleich
- 10 Marktstellung in Deutschland
- 11 Anwendungsformen und Handelsnamen
- 12 Synthese
- 13 Hinweis
- 14 Einzelnachweise
Geschichte
Metamizol ist ein Analgetikum aus der Reihe der Pyrazolone. Deren Entwicklung begann um 1875 mit der Entdeckung des Phenylhydrazins durch den deutschen Chemiker und Nobelpreisträger Hermann Emil Fischer. Fischers Schüler Ludwig Knorr wollte in den 1880er Jahren aus Phenylhydrazin ein Chinolinderivat als Ersatz für das fiebersenkende und in der Chinarinde natürlich vorkommende Chinin synthetisieren. In seinem Labor setzte Knorr Phenylhydrazin mit Acetessigester um, wobei jedoch kein Chinolin-, sondern ein Pyrazol-Abkömmling entstand. Dessen Methylierungsprodukt Phenazon wurde als Antipyrin in die Therapie eingeführt und galt als „Mutter aller modernen fiebersenkenden Schmerzmittel“.
1893 entwickelte der Apotheker und Chemiker Friedrich Stolz in den Farbwerken Hoechst aus dem Antipyrin eine weitere Substanz, die eine Dimethylaminogruppe am C4-Atom trägt und die er Aminopyrin nannte; sie kam 1896 als Pyramidon auf den Markt.

Für den klinischen Einsatz bei schwerer Erkrankten wurde eine wasserlösliche und somit injizierbare Variante benötigt. Chemiker bei Meister Lucius & Brüning (ein Vorgänger der Hoechst AG) synthetisierten daraufhin, indem sie über eine Methylenbrücke eine Sulfonsäuregruppe in das Antipyrin einbrachten, das wasserlösliche Sulfamidopyrin. Die Darstellung im Jahr 1912 wird Max Bockmühl, nach anderer Quelle Friedrich Stolz zugeschrieben. Sulfamidopyrin wurde als Melubrin (eine aus dem Firmennamen „Meister Lucius & Brüning“ gebildete Abkürzung) von 1912 bis 1959 vermarktet. Im Jahr 1920 erhielten Bockmühl und Windisch als N-Methyl-Derivat von Sulfamidopyrin das Metamizol, eine wie Sulfamidopyrin ebenfalls gut wasserlösliche Substanz, die jedoch doppelt so wirksam war. Es wurde 1922 von der Firma Hoechst unter dem Handelsnamen Novalgin auf dem deutschen Arzneimittelmarkt eingeführt.
Otto Dornblüth erwähnte Novalgin 1934 in seinem Klinischen Wörterbuch als „Phenyldimethylpyrazolonmethylaminomethansulfonsaures Natrium, innerlich und parenteral anwendbares entzündungswidriges Analgeticum, Antirheumaticum und Antipyreticum der I.G. Farben.“ Früher zählte man Metamizol zu den damals so genannten kleinen (auch schwachen oder einfachen) Analgetika mit großer therapeutischer Breite. Zum Beispiel wurde es auch zur Behandlung von Kopfschmerzen empfohlen. Schon 1985 wurden das Auftreten von Knochenmarksdepressionen (Blutbildungsschäden, Leukopenien) und spezifische Allergien sowie zerebrale Krampfanfälle, Delirien und Dämmerzustände als unerwünschte Wirkungen beschrieben.
Vor allem Aminophenazon und Metamizol seien in der Pädiatrie seither in Misskredit geraten und durch Paracetamol verdrängt worden. Nach dem GKV-Arzneimittelindex ging die Verordnung von Metamizol 1991 gegenüber dem Vorjahr wohl als Folge der intensiven Diskussion über das Risiko der Metamizol-Anwendung um 4,7 Prozent zurück. Ebenso ging die Verordnung des zu DDR-Zeiten unter dem Namen Analgin vermarkteten Metamizolpräparates in den neuen Bundesländern nach der Wende 1991 gegenüber dem Vorjahr um 69,3 % zurück.
Indikationen
Metamizol ist in den EU-Ländern, in denen es durch die nationalen Zulassungsbehörden zugelassen ist, für folgende Anwendungsgebiete genehmigt:
- akute starke Schmerzen nach Trauma oder nach einem chirurgischen Eingriff,
- schmerzhafte Koliken,
- Tumorschmerzen,
- sonstige akute oder chronische Schmerzen, falls andere therapeutische Maßnahmen kontraindiziert sind,
- hohes Fieber, das auf andere Maßnahmen nicht anspricht.
Zu den schmerzhaften Koliken (viszerale Schmerzen und Kolikschmerzen) werden auch Harnleiterkoliken durch Urolithiasis sowie Gallen- und Nierenkoliken gezählt.
Die Anbieter von Metamizol-Präparaten in der Europäischen Union veröffentlichen pflichtgemäß die Anwendungsgebiete ebenso wie auch Anwendungseinschränkungen in ihren Packungsbeilagen und Fachinformationen.
Die Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) hat mehrfach gemahnt, Metamizol strikt nur innerhalb der obigen Indikationen zu verordnen. Offenbar werde aber Metamizol häufig auch bei leichten bzw. mittelstarken Schmerzen sowie (trotz wirksamer und weniger riskanter Alternativen) als Erstlinientherapie bei Beschwerden, wie beispielsweise Rückenschmerzen, eingesetzt. Bei einer solchen Anwendung von Metamizol, die auch in Deutschland weiterhin durch die Zulassung nicht abgedeckt ist („Off-Label-Use“), sei das Nutzen-Risiko-Verhältnis ungünstig, worüber der Arzt den Patienten entsprechend den Sorgfaltsanforderungen des Arzthaftungsrechts aufklären und engmaschig auf Zeichen gefährlicher Nebenwirkungen untersuchen muss. Der Einsatz von Metamizol sei also nur dann gerechtfertigt, wenn Paracetamol, nichtsteroidale Antirheumatika (NSAR) oder Opioide nicht ausreichen oder nicht gegeben werden dürfen. Ansonsten sei „im Fall eines Schadens der verordnende Arzt rechtlich in einer kritischen Situation“.
Kontraindikationen
Gegenanzeigen für die Gabe von Metamizol sind eine bekannte Unverträglichkeit, Erkrankungen der blutbildenden Zellreihe, eine hepatische Porphyrie (angeborene oder erworbene Störung der Produktion des roten Blutfarbstoffes) sowie ein Glucose-6-Phosphat-Dehydrogenase-Mangel. Weitere Gegenanzeigen sind ein Analgetika-Asthma-Syndrom und eine Analgetika-Intoleranz vom Urtikaria-Angioödem-Typ.
Metamizol zeigte in tierexperimentellen Studien zwar keine teratogenen Effekte, aufgrund fehlender Daten am Menschen wird aber vom Einsatz in der Schwangerschaft abgeraten. Kontraindiziert ist die Anwendung im letzten Schwangerschaftsdrittel, in der Stillzeit sowie bei Säuglingen unter drei Monaten.
Pharmakokinetik
Metamizol, das selbst ein Prodrug ist, wird zum pharmakologisch wirksamen 4-N-Methylaminoantipyrin (4-MAA) hydrolysiert. Metamizolpräparate werden intravenös, intramuskulär, rektal und (als Tabletten und Tropfen) oral verabreicht. Bei intravenöser Zufuhr ist Metamizol bereits nach 15 Minuten nicht mehr im Blut nachweisbar. Nach oraler Verabreichung gelangt es nicht in das Blutplasma, sondern wird schon im Gastrointestinaltrakt quantitativ nicht enzymatisch zu 4-MAA hydrolysiert. Letzteres wird dann nahezu vollständig resorbiert. Die Bioverfügbarkeit von Methylaminoantipyrin liegt bei etwa 90 %. 4-MAA wird in der Leber (hepatisch) verstoffwechselt und hauptsächlich über die Niere (renal) ausgeschieden. Die Plasmahalbwertzeit und die Wirkdauer betragen circa 2,5 bis 4 Stunden. Die Wirkung von intravenös verabreichtem Metamizol tritt nach 20 bis 30 Minuten ein. Eine gleichzeitige Nahrungsaufnahme kann zu einer verlangsamten Resorption von peroral verabreichtem Metamizol und damit zu einem leicht verzögerten Wirkungseintritt führen.
Wirkmechanismus
Der genaue Wirkmechanismus von Metamizol ist ungeklärt. Diskutiert werden unter anderem eine Beteiligung des 5-HT- oder Opioid-Stoffwechsels oder des cGMP-Signalweges. Seit den 1980er Jahren ist bekannt, dass Metamizol als Cyclooxygenase-Hemmer wirkt. Nach einer physiologischen Studie von 2015 blockiert Metamizol TRPA1-Ionenkanäle in Schmerzrezeptoren (Nozizeptoren).
Neben seiner schmerzlindernden und fiebersenkenden Wirkung wirkt Metamizol (in hohen intravenösen Dosen) in bestimmten Fällen (vor allem Kolikschmerzen) auch krampflösend (spasmolytisch), was durch Öffnung von Kaliumkanälen und den verminderten Einstrom von Calcium in der glatten Muskulatur erklärt wird. Metamizol wird deshalb zur Schmerztherapie bei Koliken der Gallen- und Harnwege eingesetzt.
Nebenwirkungen
Etwa die Hälfte der im deutschen Spontanmeldesystem erfassten unerwünschten Nebenwirkungen sind Hautveränderungen, darunter lebensgefährliche wie das Stevens-Johnson-Syndrom (6,5 %) und das Lyell-Syndrom (7,8 %). Etwa acht Prozent der im deutschen Spontanmeldesystem erfassten Nebenwirkungen wurden unter psychiatrische Störungen zusammengefasst. Neben Verwirrtheit und Benommenheit (Somnolenz) zählen hierzu in wenigen Einzelfällen auch Angst, Delirium, Depression, Unruhe (Agitiertheit), Halluzinationen, Konzentrationsschwäche, Sedierung und Sprachstörungen. Die Störungen können bereits bei geringer Dosierung über einige Stunden andauern.
Nach einer Übersichtsstudie von 2016 erhöhte Metamizol das gastrointestinale Blutungsrisiko im Magenbereich signifikant – je nach Einzelstudie – um den Faktor 1,4 bis 2,7 (relatives Risiko). Einzelfälle von akutem Nierenversagen mit akuter interstitieller Nephritis nichtdestruierender Natur wurden berichtet. Auch können Übelkeit und Erbrechen auftreten, gelegentlich auch eine harmlose Rotfärbung des Urins durch Stoffwechselprodukte.
In einem Rote-Hand-Brief vom 15. Dezember 2020 informierten die Zulassungsinhaber und die Aufsichtsbehörden die Fachöffentlichkeit über das sehr seltene Risiko für arzneimittelbedingte Leberschäden unter Anwendung von Metamizol. Der Entstehungsmechanismus ist weitgehend unklar, es wird eine immun-allergische Komponente angenommen. Die Leberschäden sind dem Wortlaut des Rote-Hand-Briefes nach wahrscheinlich meist reversibel.
Grundsätzlich können die Nebenwirkungen bei parenteraler Gabe verstärkt sein.
Agranulozytose
Bei einer akuten Agranulozytose handelt es sich um eine Störung der Bildung von Granulozyten im Knochenmark, einer Unterart von weißen Blutkörperchen (Leukozyten). Eine Auslösung durch Metamizol kann in einem sehr variablen Zeitintervall (ein Tag bis mehrere Monate) nach der ersten Verabreichung eintreten. Da die metamizolinduzierte Agranulozytose tödlich enden kann, sind Blutkontrollen und ein Absetzen des Medikaments sofort nach den ersten Symptomen zwingend erforderlich.
Als Symptome können zuerst lokale Infekte mit Halsschmerzen, Schleimhautschäden (Ulzera), Fieber und Schüttelfrost und später eine Generalisierung des Infekts (Sepsis) auftreten. Als Therapie werden – neben dem Ausschalten des Auslösers – Antibiotika und eventuell Granulozyten-Transfusionen oder Stimulationsfaktoren (G-CSF) gegeben. Bei Absetzen des Auslösers ist die Bildungsstörung oft reversibel, in einer relevanten Anzahl von Fällen jedoch nicht oder zu spät. Selbst in Ländern mit hochentwickelter medizinischer Versorgung, wie Schweden und Deutschland, starb nahezu jeder Vierte (23 % und 23,6 %) derer, die unter Metamizol eine Agranulozytose entwickelt hatten. Neben der Agranulozytose kommen auch Fälle mit einer Blutbildstörung (Neutropenie), jedoch ohne klinische Symptome, vor.

Parallel zur Zunahme der Verordnungen von Metamizol in Deutschland seit 1990 ist hier eine Zunahme der Spontanmeldungen von Agranulozytosen durch Metamizol zu verzeichnen: Während 1990 noch eine Inzidenz von weniger als zehn Fälle berichtet wurde, lag die Zahl der Meldungen um 2010 im Durchschnitt bei über 30 und im Jahr 2012 bei über 50 pro Jahr. Bei zwei Dritteln der Fälle trat die Agranulozytose innerhalb von 6 Wochen nach (dauernder oder zeitweiser) Einnahme auf, bei 30,5 % innerhalb von 7 Tagen und in 18 Fällen direkt nach ein- oder zweimaligem Gebrauch. 38 Fälle (23,6 %) endeten tödlich. Zwar gelangte 1986 eine vom deutschen Hersteller Hoechst bezahlte Studie zu einer Schätzung der Häufigkeit von lediglich 1,1 pro 1 Million Anwendungen pro Woche. Diese Studie wurde jedoch wegen schwerwiegender methodischer Fehler heftig kritisiert. Tatsächlich ergab beispielsweise eine schwedische Studie von 2002 bei Auswertung dortiger Systeme personenbezogener Arzneimittelstatistik und ärztlicher Meldepflichten ein weitaus höheres Risiko der Agranulozytose von mindestens 1 pro 1439 Verordnungen. Eine vergleichbare Studie von 2014, die die Daten der größten deutschen gesetzlichen Krankenkasse (Techniker Krankenkasse) nutzen konnte, bestätigte die schwedischen Ergebnisse von 2002 auf einer noch größeren Datenbasis.
Bei Tieren ist eine Agranulozytose bislang nicht beschrieben. Lediglich bei Pferden wurde nach mehrmaliger Anwendung hoher Dosen eine Leukopenie festgestellt.
Anaphylaktische, anaphylaktoide und allergische Reaktionen
Bei zu hoher Injektionsgeschwindigkeit bei intravenöser Injektion von Metamizol besteht ein Risiko von 0,1 bis 1 % eines anaphylaktischen Schocks, eines lebensbedrohlichen Zustands, der sehr schnell eintreten kann und ein Todesrisiko von 25 % mit sich bringt. Auch nach oraler Einnahme kann es zu einem anaphylaktischen Schock kommen.
In der BRD erfragte 1980 das Bundesgesundheitsamt von den Herstellern 260 derartige Schock-Fälle, die auf Metamizol zurückgeführt wurden, davon 205 nach Injektionen und 54 nach Tabletten und Zäpfchen. Von der Gesamtzahl verliefen – gemäß den Meldungen – 35 tödlich.
Aufgrund dieses Risikos sind in Italien seit 1979 und in Ägypten seit 1983 Injektionspräparate mit einer Dosis von mehr als 1 Gramm nicht mehr zugelassen.
Bei Personen, bei denen eine Neigung zu allergischen Reaktionen, zu Asthma oder zu chronischen Atemwegsinfektionen besteht, kann es zu einer starken allergischen Hautreaktion bis zu einem Asthmaanfall kommen. Wenn Allergien gegen Analgetika oder das Süßungsmittel Saccharin vorhanden sind, sollte besondere Vorsicht geboten sein.
Thrombozytenaggregationshemmung
Eine reversible Hemmung der Thrombozytenaggregation und damit verzögerter Blutgerinnung ist bekannt. Labortechnisch ist diese vergleichbar mit der Wirkung anderer Schmerzmittel der Gruppe der NSAR. Dadurch kann es bei gleichzeitiger Einnahme zu einer Herabsetzung der Wirksamkeit des stärkeren Thrombozytenaggregationshemmers Acetylsalicylsäure kommen.
Blutdruckabfall
Insbesondere bei schneller intravenöser Injektion kann es zu Blutdruckabfällen kommen.
Wechselwirkungen
Metamizol bewirkt eine Abnahme des Ciclosporin-Serumspiegels, weshalb dieser bei gleichzeitiger Anwendung kontrolliert werden muss. Weiterhin kann die Wirkung von Diuretika abgeschwächt werden.Cimetidin kann die Plasmakonzentration von Metamizol um ungefähr 70 % erhöhen.
Gesundheitspolitische Bedeutung (Pharmakovigilanz)
2015 veröffentlichte eine Forschungsgruppe an der Oxford University eine Analyse der weltweiten Reaktionen von Behörden der Arzneimittelzulassung auf Berichte von Todesfällen durch Medikamente nach deren Marktzulassung. Für den Zeitraum von 1950 bis 2013 wurden 95 Medikamente gefunden, bei denen die Zulassung aufgrund dokumentierter Todesfälle nach der Markteinführung widerrufen wurde. In 16 der 95 Fälle war die Widerrufung jedoch von Land zu Land uneinheitlich. Metamizol wurde als Musterbeispiel für eine gravierende Uneinheitlichkeit genauer analysiert. Hier wurde der erste Todesfall 1952 berichtet, doch die ersten Verbote erfolgten erst 1974 in Norwegen und Schweden und das zuletzt erfasste Verbot erst 2013 in Indien, während eine Reihe von Ländern ihre Zulassungen beibehielten. Die Autoren dieser Studie und einer weiteren aus Kanada empfahlen eine verbesserte Überwachung bereits zugelassener Medikamente, mehr internationale Kooperation und mehr Transparenz der Verfahren sowohl bei Pharmaunternehmen als auch bei Zulassungsbehörden.
Zulassungen im internationalen Vergleich
Aufgrund des Agranulozytoserisikos wurde Metamizol in vielen Ländern vom Markt genommen bzw. nicht zugelassen, unter anderem in Schweden, Norwegen, Dänemark, Island, Frankreich, Griechenland, Irland, Australien, Japan, Singapur, Kanada, im Vereinigten Königreich, in den USA, Venezuela, Marokko, Nigeria und Saudi-Arabien. In Indien war Metamizol von Juni 2013 bis Februar 2014 verboten.
In manchen Ländern ist Metamizol bis heute rezeptfrei (over the counter) erhältlich, so z. B. in Russland,Polen,Bulgarien, der Türkei, Ägypten, Brasilien,Mexiko und Israel.
In der DDR war Metamizol unter dem Markennamen Analgin bis 1985 rezeptfrei erhältlich. In der Bundesrepublik beschloss „der Bundesrat […] am 19. Dezember 1986, noch kurz vor Weihnachten, die Rezeptpflicht“, die 1987 in Kraft trat. Die Zulassungsgeschichte in Deutschland seit 1981 wurde 2015 in einer historischen Darstellung von Peter Schönhöfer und Jörg Schaaber beschrieben, und zwar auch unter Berücksichtigung der Verflechtung von Behörden, Pharma-Industrie und Forschern.
In der Schweiz ist Metamizol nur für starke Schmerzen und hohes Fieber, die auf andere Maßnahmen nicht ansprechen, zugelassen, gehört aber trotzdem zu den meistverabreichten Arzneien. Laut einem Bericht der Neuen Zürcher Zeitung von 2019 stand es in Alters- und Pflegeheimen zu diesem Zeitpunkt nach Paracetamol auf Platz zwei.
Marktstellung in Deutschland
Trotz der Indikationseinschränkungen vervierzehnfachte sich die Zahl der verordneten Tagesdosen (Defined Daily Dose, für Metamizol definiert mit drei Gramm bei Erwachsenen) in Deutschland im ambulanten Bereich von circa zehn Millionen Tagesdosen im Jahr 1990 über 85,8 Millionen Tagesdosen im Jahr 2007 und mehr als 110 Millionen im Jahr 2009 auf mehr als 140 Millionen im Jahr 2012. Allein im Jahr 2013 betrug der Verkaufswert von Metamizol-Produkten, die von der gesetzlichen Krankenversicherung (GKV) in Deutschland erstattet wurden, mehr als 214 Millionen Euro.
Bei den privaten Krankenversicherungen (PKV) in Deutschland belegte das Metamizol-Produkt Novalgin des Herstellers Sanofi (vormals Hoechst AG) im Jahr 2010 Rang 16 der verordnungshäufigsten und mit einem Anteil von 0,13 % Rang 130 der umsatzstärksten Medikamente. Im selben Jahr erreichte ein Nachahmerpräparat (Generikum) des Herstellers Ratiopharm mit dem generischen Namen Novaminsulfon Rang 3 der verordnungshäufigsten Medikamente im Bereich der GKV.
Bei den nichtopioiden Analgetika ist seit 2010 ein auffälliger Wandel eingetreten. Die Verordnungen von Acetylsalicylsäure und Paracetamol sind in den letzten zehn Jahren um fast 70 % zurückgegangen, während das rezeptpflichtige Metamizol häufiger verordnet wurde.
Anwendungsformen und Handelsnamen
Metamizol ist in verschiedenen Darreichungsformen im Handel: Tabletten, Brausetabletten, Tropfen, Zäpfchen und Injektionslösung zur intravenösen oder intramuskulären Gabe.
Humanmedizin
- Monopräparate: Analgin (D), Berlosin (D), Metagelan (A), Minalgin (CH), Metamizol-1A /-Abz /-Aristo /-Heumann /-Hexal /-Zentiva (D), Nopain (D), Norgesic N, Novalgin (D, A, CH), Novaminsulfon -1A /-Abz /-Ratiopharm /-Zentiva (D), Nolotil (E), Optalgin (ISR)
- Kombinationspräparate mit Metamizol sind für eine humanmedizinische Verwendung in der Bundesrepublik Deutschland bereits seit 1987 nicht mehr verkehrsfähig, nachdem das Bundesgesundheitsamt metamizolhaltige Kombinationsarzneimittel als bedenklich eingestuft hatte. Auch in den USA, Australien, Japan sowie in den meisten Ländern Europas sind metamizolhaltige Kombinationsarzneimittel verboten. In Ländern wie Brasilien, Kolumbien und Costa Rica werden solche Präparate weiterhin verkauft, z. B. Buscopan composto (BR).
- Würzburger Schmerztropf
Tiermedizin
- Monopräparate: Metapyrin (D), Novaminsulfon (D), Novacoc forte (A), Novacen (D), Novasul (A), Vetalgin (A)
- Kombinationspräparate mit Butylscopolaminbromid: Buscopan compositum (D, A), Buscosol (D), Spasmium comp. (D, A)
Synthese
Metamizol-Natrium (6) kann aus dem Phenazonderivat 1 und Benzaldehyd (2) synthetisiert werden:
Dabei entsteht zunächst das Imin 3, das mit Dimethylsulfat methyliert wird und so die quartäre Ammoniumverbindung 4 ausbildet. Diese wird anschließend zu 5 hydrolysiert und reagiert dann abschließend unter Zugabe von Formaldehyd und Natriumhydrogensulfit zu Metamizol-Natrium (6).
Hinweis
Metamizol darf nicht mit Methimazol, Metamucil (Flohsamen) und Methazolamid verwechselt werden.
